Wir Menschen verlassen uns auf unser Immunsystem, um uns vor Krankheiten zu schützen, die durch Schaderreger verursacht werden. In ähnlicher Weise reagieren auch Pflanzen auf das Eindringen schädlicher Mikroben mit einer Immunreaktion. Auslöser jeder pflanzlichen Immunantwort sind so genannte Immunrezeptoren, die nicht nur die Anwesenheit von Fremdmolekülen erkennen, die von mikrobiellen Schaderregern abgegeben werden, sondern anschließend auch wirksame Schutzreaktionen zur Abwehr der Eindringlinge in Gang setzen.
Alle Mitglieder einer Familie dieser pflanzlichen Immunrezeptoren enthalten ein charakteristisches Segment, das als Toll-Interleukin-1-Rezeptor (TIR)-Domäne bezeichnet wird und als Enzym arbeitet. Das TIR Enzym spaltet Nikotinamid-Adenin-Dinukleotid (NAD+), ein in allen lebenden Zellen häufig vorkommendes, multifunktionales kleines Molekül. Der Abbau von NAD+ wiederum aktiviert weitere Immunproteine, die schließlich in der so genannten "hypersensitiven Reaktion" gipfeln, einem Schutzmechanismus, der zum Absterben von Pflanzenzellen an Berührungsstellen zum Schaderreger führt, um die Pflanze als Ganzes wirksam zu schützen. Studien haben jedoch gezeigt, dass der Abbau von NAD+ zwar wichtig ist, aber für wirksamen Pflanzenschutz noch nicht ausreicht, was darauf hindeutet, dass zusätzliche Mechanismen beteiligt sein müssen.
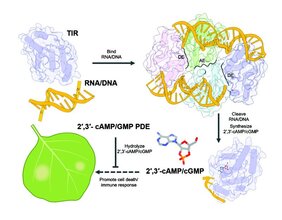
Die Autor:innen unter der Leitung der korrespondierenden Autoren Jijie Chai, der am MPIPZ, der Universität zu Köln und der Tsinghua-Universität in Peking, China, arbeitet, Paul Schulze-Lefert vom MPIPZ und Bin Wu von der School of Biological Sciences, Nanyang Technological University, Singapur, untersuchten die Funktion der TIR-Proteine. Sie konnten zeigen, dass diese Rezeptoren nicht nur NAD+ abbauen, sondern überraschend eine zusätzliche Funktion besitzen: Das TIR-Enzym spaltet auch Moleküle mit Phosphodiesterbindungen, wie sie typischerweise in RNA und DNA vorkommen, die in Zellen hauptsächlich als große, lineare ein- oder doppelsträngige Moleküle vorliegen. Mit Hilfe von Strukturanalysen konnten die Wissenschaftler:innen zeigen, dass die TIR-Proteine zwei unterschiedliche Raumstrukturen für die Spaltung von NAD+ oder RNA/DNA bilden, was erklärt, wie ein und dasselbe Protein zwei Aufgaben erfüllen kann.
Um die RNA/DNA-Moleküle zu spalten, folgen die TIR-Proteine der Kontur der RNA/DNA-Stränge und wickeln sich eng um sie wie Perlen auf einer Schnur. Die Fähigkeit der TIR-Proteine durch unterschiedliche Aneinanderlagerung zwei alternative Raumstrukturen von Molekülkomplexen zu bilden, ist ein Merkmal der gesamten Immunrezeptorfamilie. Im Unterschied zu einem Gestaltungsleitsatz aus Design und Architektur in der die Form der Funktion folgt, ist es bei den TIR-Proteinen genau umgekehrt: die Funktion, also die jeweilige Enzymaktivität, folgt der jeweiligen TIR-Raumstruktur.
Die Autor:innen konnten zeigen, dass die Spaltung von RNA/DNA Molekülen durch TIR-Proteine noch nicht für die Aktivierung des Zelltodes von Pflanzenzellen ausreicht. Spezifische kleine Moleküle, die beim Abbau von RNA und DNA entstehen, sind dafür verantwortlich. Mit Hilfe der analytischen Chemie konnten die Wissenschaftler:innen die Moleküle als cAMP/cGMP (zyklisches Adenosinmonophosphat/zyklisches Guanosinmonophosphat) identifizieren, sogenannte zyklische Nukleotide, die in allen Lebewesen vorkommen. Interessanterweise zeigte die Analyse der Autor:innen, dass die TIR-Domänen statt der gut charakterisierten 3′,5′-cAMP/cGMP Moleküle die Produktion von deren ‚Cousins‘, den so genannten nicht-kanonischen 2′,3′-cAMP/cGMP Molekülen auslösten - deren genaue Rolle bisher rätselhaft war. Wenn die Autor:innen die TIR-vermittelte Produktion von 2′,3′-cAMP/cGMP verringerten, war die Zelltodaktivität beeinträchtigt, was zeigt, dass die 2′,3′-cAMP/cGMP-Moleküle für die pflanzliche Immunantwort wichtig sind.
Wenn 2′,3′-cAMP/cGMP den Zelltod in Pflanzen als Reaktion auf eine Infektion fördern, dann ist es nur konsequent, dass deren Molekülspiegel in gesunden Pflanzen streng kontrolliert wird. In der Tat entdeckten die Forschenden, dass ein negativer Regulator der TIR-Funktion in Pflanzen, das Enzym NUDT7, die Spaltung der zyklischen 2′,3′-cAMP/cGMP Nukleotide bewirkt. Bemerkenswerterweise werden ähnliche negative Regulatoren von bestimmten pathogenen Mikroorganismen während der Infektion in Pflanzenzellen freigesetzt, und diese Studie konnte zeigen, dass diese pathogenen Proteine ebenfalls 2′,3′-cAMP/cGMP spalten. Dies zeigt, dass einige Mikroorganismen clevere Strategien entwickelt haben, um den 2′,3′-cAMP/cGMP-abhängigen pflanzlichen Abwehrmechanismus zu ihrem eigenen Vorteil lahm zu legen.
Dongli Yu, einer der drei Erstautoren dieser Studie, zusammen mit Wen Song und Eddie Yong Jun Tan, fasst die Bedeutung seiner Studie so zusammen:
„Wir haben eine neue Rolle für die TIR-Domäne von Immunrezeptoren zum Schutz von Pflanzen vor Infektionen identifiziert. Zukunftsweisend wird die Identifizierung von Andockstellen der 2′,3′-cAMP/cGMP Nukleotide in Zellen zu neuen Strategien führen, um Pflanzen widerstandsfähiger gegen schädliche Mikroben zu machen und auf diese Weise zur Ernährungssicherheit beitragen."
(Max-Planck-Institut für Pflanzenzüchtungsforschung)
Originalpublikation: