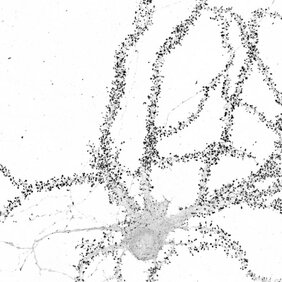
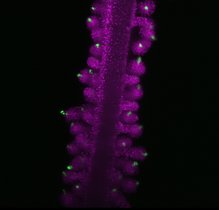
Neuronen kommunizieren über weite Entfernungen und bilden bemerkenswert komplexe und verschlungene Netzwerke. Ihre Fortsätze, Dendriten und Axone, sind zwischen Hunderten von Mikrometern und bis zu einem Meter lang und stellen bis zu Zehntausende von Verbindungen, Synapsen, mit anderen Gehirnzellen her. Es wird angenommen, dass die Stärkung oder Schwächung dieser Verbindungen, die "synaptische Plastizität", ein wesentlicher Bestandteil unserer Fähigkeit zu lernen und sich zu erinnern ist. Ein wichtiges Merkmal der synaptischen Plastizität ist eine schnelle und dynamische Veränderung der an den Synapsen vorhandenen Proteine. Bei den großen Entfernungen, die diese Zellen überbrücken, ist die schnelle Versorgung der entfernten Stellen mit Proteinen eine große logistische Herausforderung. Neuronen lösen dieses Problem zum Teil, indem sie die Baupläne für Proteine (mRNAs, die Boten) in ihren Dendriten und Axonen positionieren - und so der Zelle die Möglichkeit geben, Proteine je nach Bedarf vor Ort herzustellen.
Während Tausende von mRNAs an weit entfernten Stellen innerhalb von Neuronen lokalisiert sind, ist wenig darüber bekannt, wie sie zu diesen entfernten Stellen gelangen und wie sie sich während der synaptischen Plastizität verhalten. Um diese Wissenslücke zu schließen, entwickelte ein Team von Wissenschaftlern unter der Leitung von Erin Schuman, Direktorin am Max-Planck-Institut für Hirnforschung, und dem Heckel-Labor an der Goethe-Universität (Frankfurt) eine Strategie zur Markierung und Verfolgung neuronaler mRNAs in lebenden Neuronen. Mit Hilfe eines speziellen "molekularen Beacons" zur Bindung einzelner mRNAs und (mittels) hochauflösender Mikroskopie in lebenden Neuronen verfolgten und bewerteten sie, wie drei verschiedene mRNAs innerhalb von Dendriten transportiert werden.
"Wir fanden bemerkenswert ähnliche Bewegungen für einzelne mRNAs, was auf eine gemeinsame Methode zur Steuerung ihrer Bereitstellung an entfernten Orten hindeutet", sagt Paul Donlin-Asp, der Postdoc, der die Arbeit leitete. "Die Erzeugung zwei verschiedener Formen von synaptischer Plastizität, von denen die eine die Verbindungen zwischen Neuronen stärkt und die andere sie schwächt, führte dazu, dass sich die mRNAs weniger bewegten und sich in der Nähe der Synapsen anhäuften. Dies deutet darauf hin, dass die Synapsen die mRNAs aufgreifen, um neue Proteine herzustellen", erklärt Donlin-Asp.
Indem sie eine Reihe von Strategien einsetzten, um die Produktion der Proteine zu beobachten, die von diesen mRNA-Bauplänen kodiert werden, fanden die Wissenschaftler heraus, dass Änderungen im Verhalten der mRNAs während der synaptischen Plastizität nicht unbedingt zu einer Änderung in der Produktion des Proteins führen.
"Diese Ergebnisse deuten darauf hin, dass während der synaptischen Plastizität mRNAs zunächst "eingefangen" werden, um sie später in Protein umzuwandeln", sagt Schuman.
Max-Planck-Institut für Hirnforschung
Originalpublikation:
Paul G. Donlin-Asp, Claudio Polisseni, Robin Klimek, Alexander Heckel, and Erin M. Schuman. Differential regulation of local mRNA dynamics and translation following long-term potentiation and depression. Proceedings of the National Academy of Sciences Mar 2021, 118 (13) e2017578118