Forschende um Oscar Sánchez-Carranza im Labor von Professor Gary Lewin am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft haben eine neue Funktion für das PIEZO2-Protein identifiziert: Es vermittelt chronische Schmerzüberempfindlichkeit. Die Forschungsergebnisse deuten auf ein mögliches neues Ziel für Schmerzmittel hin. Sie könnten auch erklären, warum Schmerzmedikamente, die auf spannungsgesteuerte Natriumkanäle abzielen, als klinische Ansatzpunkte schlecht geeignet sind. Die Studie wurde in der Fachzeitschrift „Brain“, einer führenden Fachzeitschrift für Neurologie, veröffentlicht.
„Es gibt eine Korrelation zwischen chronischen Schmerzen und der Sensibilisierung von Schmerzrezeptoren beim Menschen, den so genannten Nozizeptoren“, sagt Lewin. „Unsere Studie zeigt, dass der PIEZO2-Kanal ein entscheidender Vermittler von sensorischen Signalen ist, die chronische Schmerzen aufrechterhalten.“
Das PIEZO2-Protein bildet einen Ionenkanal in menschlichen sensorischen Rezeptoren. Frühere Studien haben gezeigt, dass der Ionenkanal an der Kommunikation des Tastsinns mit dem Gehirn beteiligt ist. Menschen mit „Loss of Function“-Mutationen im PIEZO2-Gen reagieren unter-empfindlich auf sanfte Berührungen oder Vibrationen. Im Gegensatz dazu werden bei Patient*innen mit „Gain-of-Function-Mutationen“ in PIEZO häufig komplexe Entwicklungsstörungen diagnostiziert. Ob jedoch Gain-of-Function-Mutationen für die mechanische Überempfindlichkeit verantwortlich sind, ist nie bewiesen worden. Die englische Bezeichnung „Gain-of-function-Mutation“ bedeutet: Das Gen kann hinterher mehr als vorher.
Mutation sensibilisiert Nozizeptoren dramatisch
Um den Zusammenhang zu untersuchen, erzeugte Sánchez-Carranza zwei Stämme sogenannter „Gain-of-Function“-Mäuse, die jeweils eine andere Version eines mutierten PIEZO2-Gens tragen. Er ging davon aus, dass die Berührungsrezeptoren dieser Mäuse hochempfindlich sein würden. In zellbiologischen Experimenten stellte sein Team fest, dass PIEZO2-Mutationen einen starken Einfluss auf die Aktivität des Ionenkanals haben. Eine Mutation bewirkt beispielsweise, dass sich der Kanal mit zehnmal weniger Kraft öffnet als normale, nicht mutierte Kanälen.
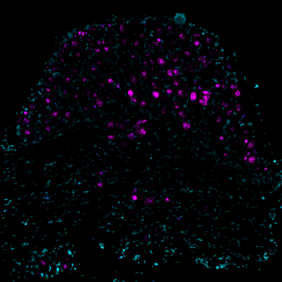
Mit elektrophysiologischen Methoden, die im Lewin-Labor entwickelt wurden, maßen Sánchez-Carranza und seine Kolleg*innen die elektrische Aktivität in sensorischen Neuronen, die aus den transgenen Mäusen isoliert wurden. Sie fanden heraus, dass die Mutationen nicht nur die Berührungsrezeptoren wie erwartet sensibilisierten, sondern auch nozizeptive Rezeptoren – Neuronen, die schmerzhafte mechanische Reize erkennen – dramatisch empfindlicher für mechanische Reize machten.
Darüber hinaus entdeckten die Forschenden, dass die Nozizeptoren durch mechanische Reize aktiviert wurden, die üblicherweise lediglich als leichte Berührung empfunden würden.
„Normalerweise muss die Haut fast quetschen, um Nozizeptoren zu aktivieren“, erklärt Sánchez-Carranza. „Die Nozizeptoren der transgenen Mäuse wurden dagegen durch mechanische Einwirkung ausgelöst, die sonst als Berührung wahrgenommen würde. Sie waren unglaublich sensibel.“
Dass eine einzige Mutation in PIEZO2 ausreichte, um die Physiologie der Nozizeptoren von einem Neuronentyp auf einen anderen zu verändern, sei besonders überraschend, sagt Lewin. Noch wichtiger aber ist, dass die Neuronen weiter feuerten, auch wenn der Reiz entfernt wurde. Die Studie bringt erstmals Gain-of-Function-Mutationen im PIEZO2-Gen mit Schmerzrezeptoren in Verbindung.
PIEZO2 könnte an Schmerzsyndromen wie Fibromyalgie beteiligt sein
Klinische Studien haben gezeigt, dass bei Patient*innen mit chronischen Schmerzsyndromen wie Fibromyalgie und Small-Fiber-Neuropathien die C-Faser-Nozizeptoren, also die sensorischen Rezeptoren, die Schmerzen auslösen, hyperaktiv sind. Als Forschende die Aktivität von Nozizeptoren in diesen Fällen aufzeichneten, stellten sie fest, dass diese ohne jeglichen mechanischen Reiz aktiv waren. Allerdings war der Mechanismus unklar.
„Wir zeigen, dass wir allein durch die Veränderung einer Aminosäure in PIEZO2 tatsächlich viel von dem nachahmen können, was bei chronischen Schmerzen in den C-Fasern geschieht“, sagt Lewin. Beim Menschen „könnte PIEZO2 an vielen der genannten Erkrankungen beteiligt sein.“ Nozizeptive Neuronen sind die größte Art von sensorischen Neuronen, die die Haut ausstatten – wir Menschen haben viermal mehr Schmerzrezeptoren in der Haut als Tastrezeptoren.
Laut einer Studie der U.S. National Institutes of Health aus dem Jahr 2023 leiden bis zu 20 Prozent der erwachsenen Bevölkerung an chronischen Schmerzen, die sich mit den vorhandenen Medikamenten schlecht behandeln lassen. Dieselbe NIH-Studie ergab, dass zwei Drittel der Menschen, die 2019 über chronische Schmerzen klagten, auch ein Jahr später noch litten.
Die Ergebnisse deuten nun darauf hin, dass ein bestimmter Aspekt des Öffnungsmechanismus des PIEZO2-Kanals durch neue Schmerzmittel gezielt angegriffen werden könnte. Viele Bemühungen, neue Analgetika zu entwickeln, hätten sich bislang auf spannungsgesteuerte Natriumkanäle konzentriert – mit begrenztem Erfolg, sagt Lewin. „Wenn sie die Ursache der Sensibilisierung von Nozizeptoren angehen, könnten neue Medikamente Patient*innen mit chronischen Schmerzen eine Linderung verschaffen.“
Max Delbrück Center
Originalpublikation:
Oscar Sánchez-Carranza, Sampurna Chakrabarti, Johannes Kühnemund, Fred Schwaller, Valérie Bégay, Jonathan Alexis García-Contreras, Lin Wang, Gary R Lewin: Piezo2 voltage-block regulates mechanical pain sensitivity, Brain, 2024;, awae227, https://doi.org/10.1093/brain/awae227