Auch in einem Jahr ohne Weihnachtsmärkte verbinden wir die Adventszeit mit Düften wie etwa Zimt oder Kerzenrauch. Während das Zustandekommen von Seh- oder auch Höreindrücken weitgehend aufgeklärt ist, hat man bislang nur teilweise verstanden, wie und auf welcher Ebene des Gehirns solche Duftsignale abgebildet werden und wie aus dieser Abbildung Dufteindrücke entstehen. Die erste Verarbeitungsebene jenseits der Nase ist dabei der sogenannte Bulbus olfactorius oder Riechkolben, dessen Neurone von den Riechsinneszellen innerviert werden.
Die meisten Neurone des Säugergehirns tragen auf ihren Dendriten, den Zellfortsätzen, kleine Ausstülpungen (Dornfortsätze oder „Spines“ genannt), auf denen die synaptischen Kontakte zu den vorgeschalteten Neuronen hauptsächlich lokalisiert sind. Die Körnerzellen des Bulbus olfactorius – eine Art lokales Neuron und der häufigste Nervenzelltyp in diesem Hirnareal – verfügen über Spines, die nicht nur erregende Eingangssignale erhalten, sondern auch selbst Botenstoffe freisetzen können – sogenannte reziproke Synapsen.
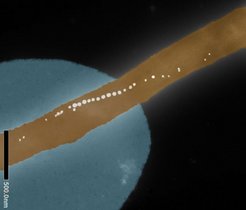
Ein Team aus Wissenschaftler:innen um Veronica Egger, Professur für Neurophysiologie an der Universität Regensburg, hat nun erstmals experimentell mittels hochauflösender optischer Methoden nachgewiesen, dass die Freisetzung von Botenstoff aus diesen reziproken Spines mittels eines auf den Spine beschränkten Aktionspotentials erfolgt. Überraschenderweise ist für die Auslösung der Freisetzung aber die gleichzeitige Aktivierung sogenannter NMDA-Rezeptoren erforderlich, die sonst für die Erzeugung von Eingangssignalen relevant sind. In Kollaboration mit Kolleginnen und Kollegen aus Teheran und Turin konnte ein möglicher Mechanismus für solch eine neuartige Kooperation beschrieben werden. Die Ergebnisse der Arbeit sind jetzt in der Fachzeitschrift eLife erschienen.
Jenseits dieser ungewöhnlichen subzellulären Vorgänge hat der Befund auch eine weitergehende Bedeutung für die Kodierung von Duftreizen. Diese erfolgt kombinatorisch, da jedes Duftmolekül üblicherweise eine große Anzahl von Duftrezeptoren aktiviert. Alle Rezeptoren desselben Typs regen nun ein nachgeschaltetes Modul von Neuronen des Bulbus olfactorius an, das seinerseits in die olfaktorische Hirnrinde verschaltet ist. Aus dieser Aktivierung mehrerer Module wird eine Duftwahrnehmung synthetisiert (genauso wie ein musikalischer Akkord mehrere Gruppen frequenzselektiver Neurone der Hörbahn aktiviert und daraus schließlich eine Wahrnehmung des Gesamtklangs entsteht). Die Rezeptormodule wechselwirken im Bulbus nicht direkt, sondern stehen unter anderem über Körnerzellen miteinander in Verbindung. Die beobachtete Kooperation legt nun nahe, dass die Synthese der Duftwahrnehmung bereits auf der Ebene des Bulbus olfactorius in einer sehr effizienten Weise beginnt, indem die Körnerzellen ausschließlich gleichzeitig aktive Module miteinander verschalten und die Aktivität dieser Module synchronisieren.
Universität Regensburg
Originalpublikation:
Lage-Rupprecht, V., Zhou, L., Bianchini, G., Aghvami, S. S., Mueller, M., Rózsa, B., Sassoè-Pognetto, Egger, V. (2020). Presynaptic NMDARs cooperate with local spikes toward GABA release from the reciprocal olfactory bulb granule cell spine. eLife 2020;9:e63737. DOI:10.7554/eLife.63737