Ähnlich wie beim Menschen ist auch für Zebrafische das Sehen eine überaus wichtige Fähigkeit. So sind große Gehirnbereiche auf das Verarbeiten visueller Eindrücke spezialisiert und auch bei der Orientierung und der Nahrungssuche verlassen sich die Tiere vorwiegend auf ihre Augen. Junge Zebrafische lernen, geeignete von ungeeigneter Nahrung zu unterscheiden und merken sich die Stellen, an denen sie zuvor Nahrung gefunden haben. Bei solchen erfahrungsabhängigen Lernprozessen entstehen im Gehirn neue Verknüpfungen zwischen Nervenzellen und bereits bestehende Verbindungen werden gefestigt.
„Bei der Gehirnentwicklung unterscheiden wir zwischen angeborenen und erfahrungsabhängigen Prozessen“, erklärt Herwig Baier, Direktor am Max-Planck-Institut für biologische Intelligenz. „Der Aufbau neuronaler Schaltkreise, zum Beispiel im visuellen Zentrum des Gehirns, gilt als erfahrungsabhängiger Prozess. Die zellulären Netzwerke werden dabei nach bisherigem Wissen durch visuelle Reize und neuronale Aktivität geformt.“ Aber was passiert, wenn solche visuellen Informationen nicht vorhanden sind?
Um dieser Frage auf den Grund zu gehen, haben Wissenschaftlerinnen und Wissenschaftler zum Beispiel untersucht, wie sich Fische oder Mäuse entwickeln, wenn sie in vollständiger Dunkelheit aufwachsen. In diesem Fall erreichen keine visuellen Informationen das Gehirn – und dennoch senden die Augen viele Signale an das Gehirn. Normalerweise wandelt die Netzhaut die als Photonen eintreffenden Helligkeitsmuster in elektrische Impulse um. Diese werden dann über spezialisierte Zellen mit langen Axonen, die so genannten retinalen Ganglienzellen, an das Gehirn weitergeleitet. Die retinalen Ganglienzellen entscheiden darüber, welche visuellen Reize überhaupt in das Gehirn gelangen. Aus ihrem Aktivitätsmuster ergeben sich sämtliche visuelle Informationen, die einem Tier über seine Umwelt zur Verfügung stehen. Doch es gibt weitere Formen der Kommunikation zwischen Augen und Gehirn.
Während sich ein Tier entwickelt, können retinale Ganglienzellen auch spontan neuronale Aktivität erzeugen. Manchmal schwappen ganze Wellen elektrischer Aktivität über die gesamte Netzhautoberfläche. Auch diese Signale werden an die entsprechenden Gehirnbereiche weitergeleitet und können dort die als Synapsen bekannten Verknüpfungen zwischen Nervenzellen modifizieren. Außerdem sezernieren die retinalen Ganglienzellen Wachstumsfaktoren ins sich entwickelnde Gehirn. All diese Faktoren könnten den Schaltplan des Gehirns beeinflussen. In früheren Studien wurden sie jedoch meist nur unabhängig voneinander erforscht – zum Beispiel bei der Frage, wie sich Blindheit auf die Gehirnentwicklung auswirkt.
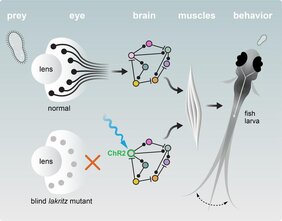
„Um wirklich zu verstehen, wie sehr die Gehirnentwicklung von der Stimulation durch die Augen abhängig ist, müssen wir die retinalen Ganglienzellen aus der Gleichung herausnehmen“, sagt Shachar Sherman, Erstautor einer neuen Studie, die genau dies erforscht hat. Der Doktorand in der Abteilung von Herwig Baier und seine Kolleginnen und Kollegen untersuchten dazu eine Zebrafischmutante, die als lakritz bekannt ist. Die lakritz-Mutante trägt einen Gendefekt, der sich ausschließlich auf die Augen beschränkt und die Entwicklung aller retinalen Ganglienzellen verhindert. Wären die lakritz-Zebrafische nicht deutlich dunkler als ihre Geschwister ohne Gendefekt, könnte man sie nicht voneinander unterscheiden.
„Die lakritz-Mutante ist nicht bloß blind. Sie ist tiefblind, da das Gehirn vollständig von der visuellen Außenwelt und sämtlichen Signalen der Netzhaut abgeschnitten ist“, erklärt Herwig Baier. „Diese Besonderheit ermöglicht es uns, systematisch zu untersuchen, wie sich Gehirn und Verhalten entwickeln, wenn retinale Ganglienzellen ganz fehlen.“
Das Team um Shachar Sherman zog daher junge lakritz-Zebrafische auf und verglich ihre Gehirnentwicklung mit der von Zebrafischen ohne Gendefekt. Ein in der Abteilung erstellter, virtueller Zellatlas des Zebrafischgehirns half ihnen dabei, einzelne Zellen zu identifizieren und ihre Entwicklung zu verfolgen. „Zu unserer Überraschung konnten wir keinen großen Unterschied feststellen“, sagt Sherman. „Alle Nervenzelltypen bildeten sich auch bei lakritz an der richtigen Stelle und in der richtigen Anzahl, nur die Geschwindigkeit ihrer Entwicklung wich leicht ab.“
Da sich die Gehirne der lakritz-Zebrafische insgesamt relativ normal entwickelten, drängte sich den Wissenschaftlern eine Folgefrage auf: Können diese Fische Verhaltensweisen ausführen, die normalerweise durch optische Reize ausgelöst werden? Um dies herauszufinden untersuchte das Team zwei entsprechende Verhaltensweisen: die Orientierung der Fische in Richtung eines Beutetiers und die sogenannten optokinetischen Augenbewegungen, die Bilder der Außenwelt auf der Netzhaut stabilisieren.
„Da lakritz-Fische nichts sehen, würden sie diese Verhaltensweisen normalerweise nie zeigen. Aber die Schaltkreise im Gehirn könnten trotzdem funktionieren und sozusagen darauf warten, aktiviert zu werden“, so Sherman. Um dies zu testen, nutzte das Team die Optogenetik: Mit Hilfe von Licht können jene Neurone direkt aktiviert werden, die normalerweise nur bei einem entsprechenden Reiz aktiv wären. Die Methode ermöglicht es Neurowissenschaftlern, ‚Lichtschalter‘ in die Nervenzellen im Gehirn einzubauen. So können die Forscher die neuronale Aktivität von außen steuern – vorausgesetzt sie erreichen die entsprechenden Zellen mit Lichtimpulsen. Bei jungen Zebrafischen funktioniert dies besonders gut, da die Tiere klein und durchsichtig sind. „Und tatsächlich reagierten die lakritz-Zebrafisch auf diese künstlichen Reize genau so, als ob sie wirklich ein Beutetier gesehen hätten“, erinnert sich Shachar Sherman. „Das zeigt uns, dass sich die dafür erforderlichen Gehirnschaltkreise auch dann entwickeln und ordnungsgemäß funktionieren, wenn es überhaupt keinen Input von den Augen gibt.“
Zusammengefasst zeigen die Forschungsergebnisse, dass sich das Gehirn stärker als bislang angenommen entlang angeborener Pfade entwickelt. „Dank Shachars Forschung wissen wir nun, dass sich ein hochkomplexer Bereich des Wirbeltiergehirns mit mehreren Dutzend Zelltypen auch ganz ohne Sinneseindrücke normal entwickeln kann“, sagt Herwig Baier. „Unsere Ergebnisse unterstreichen die Bedeutung genetisch vorgegebener Programme für die Gehirnentwicklung. Was bei Zebrafischen funktioniert, könnte vielleicht auch für größere Tiere funktionieren.“
Künftige Studien werden zeigen, wie stark die Entwicklung der sensorischen Systeme im Tierreich insgesamt von äußeren Reizen abhängt; die Augen und visuellen Gehirnbereiche sind nur ein Beispiel. Je mehr wir über diese Prozesse wissen, desto näher kommen wir der Antwort auf die philosophische Frage „Was ist Genetik und was ist Erziehung?“ – oder, anders gesagt, zu welchem Anteil Aspekte unserer Entwicklung determiniert sind oder von unserer Umgebung abhängen. Für das visuelle System, zumindest beim Zebrafisch, scheint die Genetik die entscheidende Triebkraft zu sein.
Max-Planck-Institut für biologische Intelligenz
Originalpublikation:
Sherman, S., Arnold-Ammer, I., Schneider, M.W. et al. Retina-derived signals control pace of neurogenesis in visual brain areas but not circuit assembly. Nat Commun14, 6020 (2023). doi.org/10.1038/s41467-023-40749-1