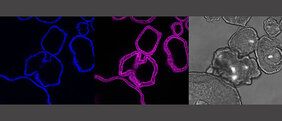
Inzwischen können Forscherinnen und Forscher im Labor von praktisch all unseren Organen – darunter Haut, Gehirn und Darm – Miniaturversionen bilden. Man bezeichnet die dreidimensionalen Gebilde, die sich aus Stammzellen herstellen lassen, als „Organoide“. Organoide sind mit einem Durchmesser von 0,5 Millimetern zwar nur etwa so groß wie ein Senfkorn, zeigen aber eine frappierende Ähnlichkeit mit den realen Organen. „Obwohl sie winzig sind, bilden die Organoide das ursprüngliche Organ sehr gut nach“, sagt Dr. Sina Bartfeld, die Leiterin der Studie vom Zentrum für Infektionsforschung am Institut für Molekulare Infektionsbiologie der JMU. „Im Organoid sind die gleichen Zelltypen vorhanden, wie im echten Organ. In den Stammzellen, aus denen die Organoide entstehen, ist dabei auch eine Art Gewebsidentität einprogrammiert. Die Stammzelle weiß sozusagen, aus welchem Organ sie kommt, und produziert auch in der Kulturschale diejenigen Zellen, die in diesem Organ im Körper vorhanden sind.“
Mini-Organe des Magens, Dünndarms und Dickdarms analysiert
In Zusammenarbeit mit dem Chirurgen Armin Wiegering der Uniklinik Würzburg, generierte das Team um Sina Bartfeld Mini-Organe des Magens, des Dünndarms sowie des Dickdarms. Dabei stießen sie auf eine überraschend große molekulare Komplexität. Dies ergab die Analyse der Sequenzierung der RNA, die die Genaktivität der Zellen widerspiegelt. Beispielsweise zeigte sich: Die Organoide der verschiedenen Abschnitte des Magen-Darm-Traktes schalten je nach der Gewebsidentität spezielle Gen-Programme an. „Es ist jedem intuitiv verständlich, dass Magen- und Darmzellen unterschiedliche Enzyme zur Verdauung bilden müssen, aber uns hat überrascht, dass auch bestimmte Andockstellen des Immunsystems zu dieser Gewebsidentität gehören“, sagt Bartfeld.
Die spezielle Organisation dieser Immun-Andockstellen könnte eine Rolle spielen bei den Organ-spezifischen Entzündungskrankheiten. Sie könnte auch für die Krebsentstehung relevant sein, bei der ebenfalls chronische Entzündungen im Verdacht steht. Ob dies so ist und wie Entzündungsprozesse zur Krebsentstehung beitragen könnten, muss noch näher erforscht werden. Die Organoide bieten hierfür eine neue Grundlage.
Organoide lassen sich im Labor nicht nur rasch und in großer Stückzahl bilden, sie haben zudem den Vorteil, dass sie aus menschlichem Gewebe bestehen und ein menschliches Organ rudimentär nachbilden. Da die Unterschiede zwischen Tier und Mensch beträchtlich sind, können Organoide helfen, Tierversuche zu reduzieren und Krankheiten zu entschlüsseln, die es nur beim Menschen gibt. Auch bei der Entwicklung von Medikamenten spielen sie eine immer größere Rolle.
Zellen unterschieden zwischen Freund und Feind
Außerdem bieten Organoide ganz neue Möglichkeiten, molekulare Grundlagenprozesse an einem biologisch realistischen Modell zu erforschen, etwa des Magen-Darm-Trakts, auf den sich auch die Würzberger Gruppe um Bartfeld spezialisiert hat. Die Zellen, die unseren Verdauungstrakt auskleiden, die „Epithelzellen“, haben eine wichtige Barrierefunktion, die unseren Körper vor dem Eindringen von Bakterien schützt. Das können zum einen Pathogene, wie krankheitserregende Bakterien oder Viren sein. Zugleich wird der Darm von Billionen gutartigen Bakterien bevölkert (die Darmflora oder auch „Mikrobiota“ genannt), die uns bei der Verdauung von Nahrung behilflich sind. Die Epithelzellen müssen somit in der Lage sein, sowohl freundliche als auch feindliche Bakterien wahrzunehmen und auf diese adäquat zu reagieren. Dies funktioniert über spezielle Immun-Andockstellen, die als „Mustererkennungs-Rezeptoren“ (PRRs) bezeichnet werden.
Diese Immun-Andockstellen erkennen spezifische Moleküle, die von den unterschiedlichen Bakterien im Darm produziert werden. Werden Moleküle von gefährlichen Pathogenen erkannt, müssen die Epithelzellen – im Gegensatz zu jenen Molekülen der gutartigen Bakterien – Alarm schlagen und eine Immunantwort herbeiführen. Unklar ist bislang, wie das Epithel dabei zwischen Freund und Feind zu unterscheiden vermag. „Es ist ausgesprochen schwierig, die komplexen Interaktionen zwischen Immunzellen, Epithelzellen und Mikroben zu entwirren“, sagt Bartfeld. „Da aber unsere Organoide im Labor nur aus eben diesen Epithelzellen bestehen, können wir anhand der Organoide ganz reduziert beobachten, was das Epithel zu diesen Interaktionen beiträgt.“
Wichtiger Schritt in der Aufklärung von Entzündungsmechanismen
Bei ihren Untersuchungen fanden die Würzberger Forscher für jeden der untersuchten Mustererkennungsrezeptoren ein eigenes, segmetspezifisches Genaktivitäts-Muster. „Der Magen und jedes Segment im Darm hat ein eigenes, bestimmtes Repertoire von Erkennungsrezeptoren“, sagt Özge Kayisoglu, Erstautorin der Studie. „Es kommt also auch bei der Immunantwort des Epithels auf die genaue Lage an. So reagiert der Magen auf andere baktierielle oder virale Stoffe, als der Dünn- oder Dickdarm.“ Diese Unterschiede in der Immunantwort könnten möglicherweise auch zu den segmentspezifischen Krankheiten wie Colitis ulcerosa beitragen.
Woher kommt diese unterschiedliche Reaktion auf bakterielle oder virale Stoffe? Die naheliegende Vermutung der Forscherinnen und Forscher war zunächst, dass die Immunrezeptoren als Antwort auf die Besiedlung mit den gutartigen Bakterien reguliert ist. Um diese Vermutung zu testen, stellten die Wissenschaftler Organoide von Zellen her, die noch nie in Kontakt mit Bakterien waren. „Die Daten zeigen, dass es durchaus einen Einfluss des Mikrobioms gibt – aber es war überraschend und faszinierend zu sehen, dass ein Großteil der Immunerkennung des Epithels rein entwicklungsbiologisch in den Genen festgeschrieben und unabhängig von der Umwelt ist“, sagt Bartfeld.
Die gesammelten Erkenntnisse stellen einen wichtigen Schritt in der Aufklärung von Entzündungsmechanismen dar. Sie zeigen, dass jeder Abschnitt des Magen-Darm-Traktes eine spezifische Kombination von Erkennungsrezeptoren aufweist. Eine Fehlfunktion dieser angeborenen Immunität könnte die Entwicklung entzündlicher Krankheiten fördern.
Universität Würzburg
Originalpublikation:
Ozge Kayisoglu, Franziska Weiss, Carolin Niklas, Isabella Pierotti, Malvika Pompaiah, Nina Wallaschek, Christoph-Thomas Germer, Armin Wiegering, Sina Bartfeld: Location-specific cell identity rather than exposure to GI microbiota defines many innate immune signalling cascades in the gut epithelium, Gut 2020, doi: 10.1136/gutjnl-2019-319919