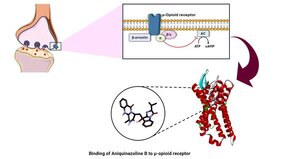
Opioide gehören zu den am längsten bekannten Naturstoffen mit pharmakologischer Wirkung und sind hervorragende Schmerzmittel. Ein bekanntes Beispiel ist Morphium, das Anfang des 19. Jahrhunderts erstmalig isoliert und synthetisiert wurde und das für Schwerkranke im letzten Lebensstadium ein Segen ist. Die Kehrseite: Bei unsachgemäßem Gebrauch können Opioide zu Abhängigkeiten führen, ebenso zu drastischen Nebenwirkungen wie Atemstillstand. In den USA wurden Opioide stark in den Medien beworben – und als Folge auch bei leichteren Beschwerden verschrieben. Den Centers for Disease Control and Prevention (CDC) zufolge gab es im Zeitraum von 1999 bis 2021 in den USA fast 645.000 Tote durch eine Opioid-Überdosis. Auch Deutschland hat die Opioidkrise bereits erreicht: Hierzulande wird vor allem Heroin mit den Wirkstoffen gestreckt. Während bei Heroin 200 Milligramm tödlich wirken, genügen bei dem Opioid Fentanyl bereits zwei Milligramm. In Deutschland starben 2022 mehr als 1.000 Personen im Zusammenhang mit dem Konsum von Opioiden.
40.000 Naturprodukte als Ausgangsbasis
Zwar schreiten die Regierungen ein, um diese Krise einzudämmen. Dennoch sind viele Menschen abhängig von Opioiden oder leiden unter Schmerzen, die gelindert werden müssen. Es besteht daher ein dringender Bedarf an sichereren Schmerzmitteln. Forschende der Johannes Gutenberg-Universität Mainz (JGU) konnten hier – mit finanzieller Unterstützung des DFG-Graduiertenkollegs „Life Sciences – Life Writing“ – einen Erfolg erzielen. „Ein Naturprodukt namens Aniquinazolin B aus dem Meerespilz Aspergillus nidulans greift ebenfalls an den Opioidrezeptoren an und könnte Opioide künftig ersetzen“, sagt Roxana Damiescu, Wissenschaftlerin in der Arbeitsgruppe von Prof. Dr. Thomas Efferth. Als Ausgangsbasis diente dem Team eine chemische Datenbank mit über 40.000 Naturprodukten. Wie gut binden diese Stoffe an den entsprechenden Rezeptor? Und haben sie die Eigenschaften, die Arzneimittel brauchen? So muss die Substanz beispielsweise eine gewisse Wasserlöslichkeit aufweisen. Da es sich um Approximationsrechnungen handelte, die umso präziser werden, je öfter sie durchgeführt werden, standen pro Substanz rund 750.000 Einzelrechnungen an. Eine solch riesige Zahl an Kalkulationen würde jeden normalen PC weit über seine Leistungsgrenzen hinaus fordern, daher nutzte das Team den Supercomputer MOGON der JGU. Die Top 100 der Wirkstoffe wurden anschließend mit weiteren Berechnungsmethoden untersucht.
Die Top Ten wurden im Labor untersucht
Für die Top Ten, die daraus resultierten, hieß es: biochemische Analyse im Labor. Als Erstes stand die Sicherheit auf dem Programm. Die Forschenden untersuchten an menschlichen Nierenzellen, ob höhere Konzentrationen des Wirkstoffs den Zellen etwas anhaben können und sie abtöten. Anschließend kamen zwei weitere Testprinzipien zum Einsatz. „Das erste widmet sich der Frage: Existiert die theoretisch vorhergesagte hohe Bindungsenergie der Substanzen an die Schmerzrezeptoren auch in der realen Welt?“, erläutert Thomas Efferth, Leiter der Abteilung Pharmazeutische Biologie. Da eine Bindung der Substanzen an die Rezeptoren allein nicht ausreicht – die Bindung muss auch die Funktion ändern –, untersuchten die Wissenschaftlerinnen und Wissenschaftler die Hemmung der biologischen Funktion mit einem zweiten Testsystem. Einer der Wirkstoffe passierte alle Tests mit Bravour: Aniquinazolin B aus dem Meerespilz Aspergillus nidulans. „Unsere Untersuchungen deuten darauf hin, dass dieser Wirkstoff eine ähnliche Wirkung haben könnte wie Opioide, jedoch deutlich weniger Nebenwirkungen aufweist“, fasst Roxana Damiescu zusammen.
Johannes Gutenberg-Universität Mainz
Originalpublikation:
Roxana Damiescu et al.: Aniquinazoline B, a fungal natural product, activates the µ-opioid receptor, ChemMedChem, 23. Mai 2024, DOI: 10.1002/cmdc.202400213, https://chemistry-europe.onlinelibrary.wiley.com/doi/10.1002/cmdc.202400213