Struktur von Clusterin: Ein Schlüsselprotein gegen neurodegenerative Erkrankungen
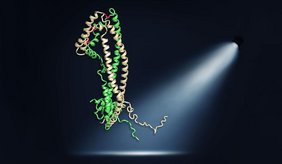
Ein Team um Patricia Yuste-Checa, Andreas Bracher und F.-Ulrich Hartl, Direktor und Leiter der Abteilung Zelluläre Biochemie, hat erstmals mithilfe der Röntgenkristallographie die dreidimensionale Kristallstruktur von menschlichem Clusterin aufgeklärt. Durch das Wissen, wie die Atome im Protein angeordnet sind, können Rückschlüsse auf die allgemeine Funktionsweise und als Chaperon gezogen werden.
Die Studie zeigt, dass Clusterin aus drei unterschiedlichen Domänen aufgebaut ist. Besonders interessant sind dabei zwei ungeordnete, hydrophobe Peptidfortsätze, die dem Protein seine bemerkenswerte Vielseitigkeit verleihen. Patricia Yuste-Checa, Erstautorin der Studie erklärt: „Der Aufbau der Peptidfortsätze erinnert an Abschnitte von kleinen Hitzeschockproteinen. Das sind molekularer Chaperone, die im Zellinneren die Proteinverklumpung verhindern, während Clusterin im extrazellulären Raum arbeitet.“
Proteine übernehmen in Zellen verschiedenste Funktionen und müssen hierfür exakt gefaltet sein. Fehlerhafte Faltung kann zur Bildung schädlicher Aggregate führen – typische Merkmale vieler neurodegenerativer Erkrankungen wie Alzheimer oder Parkinson. Molekulare Chaperone wie Clusterin spielen eine zentrale Rolle bei der Verhinderung solcher Fehlfaltungen. Clusterin, auch Apolipoprotein-J genannt, ist seit den 1980er Jahren als ergiebig freigesetztes Glykoprotein bekannt. Bislang jedoch fehlte ein detailliertes Verständnis der molekularen Funktionsweise dieses vielseitigen Schutzproteins.
Schutz vor Proteinaggregation
„Clusterin ist im extrazellulären Raum aktiv: Es bindet an fehlgefaltete Proteine, darunter die für neurodegenerative Krankheiten wie Alzheimer oder Parkinson typische Aggregationsprodukte von Amyloid-beta, Tau und α-Synuclein und verhindert ihre weitere Zusammenlagerung.“, so Patricia Yuste-Checa weiter. „In der Studie konnten wir zeigen, dass die hydrophoben, also wasserabweisenden, Peptidfortsätze von Clusterin für die Schutzfunktion essenziell sind. Nachdem wir die hydrophoben Aminosäuren in den Peptidfortsätzen biotechnologisch geändert oder entfernt hatten, haben wir die Chaperonaktivität, also die Schutzfunktion gegen Amyloid-beta Aggregation verloren.“ Auch die Bindung an Zelloberflächenrezeptoren und die Bildung von Lipoproteinkomplexen scheinen über die Peptidfortsätze vermittelt zu werden.
Bedeutung für die Medizin
Die neuen Einsichten in die Struktur und Funktion von Clusterin sind von medizinischer Relevanz. Andreas Bracher fasst zusammen: „Für Clusterin wurden zahlreiche Funktionen nachgewiesen, zunächst als Zellaggregationsfaktor, später als Apolipoprotein, Inhibitor des Komplementsystems, molekulares Chaperon und anti-apoptotischer Faktor. Es ist bekannt, das Clusterin extrazelluläre Amyloid-beta-Plaques bindet und dass der Clusterin-Spiegel im Liquor von Alzheimerpatienten erhöht ist. Die Entschlüsselung der Struktur und Mechanismus von Clusterin geben uns neue Einblicke in die extrazellulären Kontrollmechanismen der Proteinstabilität und werden hoffentlich für die klinische Erforschung und zukünftige Behandlung neurodegenerativer Krankheiten hilfreich sein.“
MPI für Biochemie
Originalpublikation:
Yuste-Checa, P., Carvajal, A.I., Mi, C. et al. Structural analyses define the molecular basis of clusterin chaperone function. Nat Struct Mol Biol (2025). doi.org/10.1038/s41594-025-01631-4