Diese TMPRSS2-vermittelte Aufnahme verändert die Immunantwort der Wirtszellen maßgeblich und treibt die Evolution des Virus voran. Sie zeigten auch, dass das sowohl bei frühen Varianten des Virus als auch bei Omikron-Varianten gilt und nicht nur bei Menschen, sondern auch bei Wild-, Haus- und Nutztieren funktioniert.
Welche Rolle spielen die Endosomen?
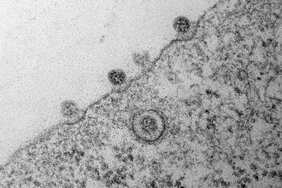
„Dass die Anwesenheit von TMPRSS2 den Eintritt von Viruspartikeln in Wirtszellen effizienter macht, ist unstrittig“, erklärt Richard Brown, „aber es waren noch viele Fragen in diesem Zusammenhang ungeklärt: In welchem Ausmaß verbessert sich der Zelleintritt? Was passiert danach in der Zelle? Funktioniert dieser Effekt nur beim Menschen?“ Um diesen Fragen auf den Grund zu gehen, infizierten die Forschenden im Zellmodell Wirtszellen mit TMPRSS2 an der Zelloberfläche und solche ohne das Protein mit unterschiedlichen Virusvarianten und beobachten unter dem Elektronenmikroskop, was passierte. Wie erwartet konnten sie sehen, dass TMPRSS2 die Virusaufnahme verbesserte. „Entgegen bisheriger Annahmen zeigte sich aber, dass der TMPRSS2-vermittelte Zelleintritt mit einer erhöhten Virusaufnahme in bestimmte zelluläre Vesikel, die Endosomen, verbunden ist“, erklärt Brown. „Bislang dachte man, der Eintrittsweg würde die Endosomen umgehen. Hierzu sind weitere detaillierte Studien nötig.“
Ebenfalls im Widerspruch zu bisherigen Annahmen steht die Beobachtung, dass auch neuere Varianten wie Omikron von der Anwesenheit des TMPRSS2-Proteins profitieren wie ältere Varianten. „Zwar benötigten die Omikron-Varianten kein TMPRSS2; die Virusaufnahme in die Wirtszellen verstärkt sich allerdings auch hier erheblich“, so Brown.
Was nach dem Eintritt geschieht
Die Forschenden wollten auch wissen, was nach dem Eintritt der Viruspartikel in die Wirtszellen geschieht. Sie konnten zeigen, dass bei allen getesteten Varianten ein effizienterer TMPRSS2-vermittelter Eintritt in die Wirtszellen zu erhöhter viraler Genomreplikation führte, gefolgt von einer gesteigerten Virusproduktion. Darauf reagieren infizierte Zellen mit einer stärkeren Immunreaktion, welche zu einem schnelleren Absterben führt. Die verstärkte Immunreaktion hat Einfluss auf die Evolution des Virus im Körper. Reagieren die Wirtszellen stärker, erweisen sich Viren mit bestimmten Mutationen als vorteilhaft und setzen sich durch.
All diese Effekte von TMPRSS2 sind nicht auf menschliche Wirte beschränkt, sondern lassen sich auch bei anderen Säugetieren beobachten, darunter sogenannte Reservoirspezies, die natürlichen Wirte von Coronaviren in freier Wildbahn sind. „Zusammengenommen bestätigen unsere Daten, dass TMPRSS2 die Erstinfektion an der Schnittstelle zwischen Virus und Wirt auf breiter Basis fördert, wobei verschiedene Säugetierarten das Potenzial haben, die kontinuierliche Evolution von SARS-CoV-2 zu beeinflussen“, resümiert Richard Brown.
Ruhr-Universität Bochum
Originalpublikation:
Bingqian Qu et al.: TMPRSS2-Mediated SARS-CoV-2 Uptake Boosts Innate Immune Activation, Enhances Cytopathology and Drives Convergent Virus Evolution, in: Proceedings of the National Academy of Sciences PNAS, 2024, DOI: 10.1073/pnas.2407437121, https://www.pnas.org/doi/10.1073/pnas.2407437121