Das Besondere dabei: die Bewegungen des Proteins können mit einer Zeitauflösung im Millisekundenbereich in Echtzeit beobachtet werden. In einer neuen Studie, die im Juli im Fachjournal Nature Communications veröffentlicht wurde, hat das Team von Prof. Dr. Grohmann das humane Argonaute2-Protein mit dieser Technik im Einzelmolekül-Mikroskop beobachtet. „Argonaute2 ist ein RNA-bindendes Protein, das Boten-RNAs mithilfe einer bereits gebundenen kleinen RNA erkennt und hemmt. Ein Großteil aller menschlichen Boten-RNAs kann durch diesen Prozess reguliert werden. Damit trägt das Argonaute2-Protein maßgeblich zu reibungslosen Abläufen in unseren Zellen bei, denn über diesen Mechanismus wird die Expression bestimmter Proteine in unseren Zellen verhindert, während andere Proteine produziert werden und ihre Funktion ausführen. Schlussendlich trägt ein funktionierendes Argonaute2-Protein so zum Beispiel zu einer korrekten neurologischen Entwicklung im Menschen bei. Funktioniert dieser Prozess nicht richtig, entstehen schwerwiegende Krankheiten.“ erklärt Dr. Sarah Willkomm, die als Erstautorin die Studie hauptverantwortlich experimentell umgesetzt hat und sich schon seit vielen Jahren mit Argonaute-Proteinen beschäftigt.
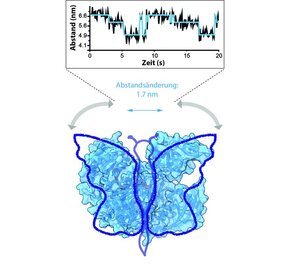
Dass Argonaute2 aus zwei „Proteinflügeln“ aufgebaut ist, wusste man schon lange. Dem Team ist es nun aber gelungen, einen Farbstoff ortsspezifisch in die jeweiligen Flügel des Argonaute2-Proteins zu koppeln, was eine Grundvoraussetzung für zeitaufgelöste FRET-Messungen ist. Mit FRET kann man den Abstand zwischen diesen Farbstoffen mit Nanometerpräzision vermessen. Dazu nutzt man die Möglichkeit, dass einer der Farbstoff gezielt angeregt werden und dann seine Energie auf den benachbarten Farbstoff übertragen kann, sodass ein Lichtsignal des benachbarten Farbstoffes detektiert werden kann. Die Effizienz dieses Energietransfers zwischen den Farbstoffen hängt direkt vom Abstand der Farbstoffe ab. Mithilfe dieser FRET-Technik konnte das Team nun in Echtzeit unter dem Mikroskop beobachten, dass die Proteinflügel von Argonaute ähnlich wie bei einem Schmetterling auf- und zuklappen. Sobald jedoch Argonaute eine kleine RNA bindet, arretieren die Flügel in einer Position. Der Flügelschlag beträgt dabei nur knapp zwei Nanometer. Eine Beobachtung der Dynamik von humanen Argonaute2 war in dieser Weise noch keiner Gruppe auf der Welt gelungen. Die Studie zeigt außerdem, dass eines der Enden der kleinen gebundenen RNA bei Bindung einer komplementären Boten-RNA von einem der Argonaute-Flügel entlassen wird. Soll der Argonaute-RNA-Komplex in der Zelle abgebaut werden, wird dagegen der RNA Duplex in einer sehr ungewöhnlichen Konformation positioniert, sodass die RNA für Nukleasen zugänglich wird und degradiert werden kann. Auch das Argonaute2-Protein selbst wird in diesem Prozess abgebaut. Die Studie profitierte nicht zuletzt von der u.a. im SFB960 gebündelten RNA- und Argonaute-Expertise der Gruppen von Prof. Dr. Grohmann und Prof. Dr. Meister am Standort Regensburg.
Universität Regensburg
Originalpublikation:
Willkomm, S., Jakob, L., Kramm, K. et al. (2022) Single-molecule FRET uncovers hidden conformations and dynamics of human Argonaute 2. Nature Communications. DOI: 10.1038/s41467-022-31480-4, https://doi.org/10.1038/s41467-022-31480-4