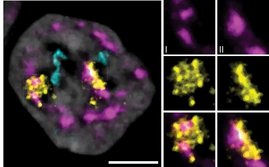
Antibiotika schützen den Nachwuchs von Bienenwölfen im Kokon vor schädlichen Pilzen. Für die Bildung der schützenden Substanzen sind Symbiose-Bakterien der Gattung Streptomyces zuständig, die in diesen Insekten leben. In einer neuen Studie in PNAS konnten Wissenschaftlerinnen und Wissenschaftler des Max-Planck-Instituts für chemische Ökologie und der Universität Mainz zusammen mit einem internationalen Forschungsteam zeigen, dass diese nützlichen Bakterien genetisches Material verlieren, das nicht mehr gebraucht wird. Das Genom der Bakterien ist von großem Interesse, um die Evolution und den Prozess der Genomerosion zu verstehen, und um nachzuvollziehen, wie sich die Kooperation und der gegenseitige Nutzen von Bakterien und ihren Wirtsinsekten über lange Zeiträume entwickelt haben.
Eine uralte Schutz-Symbiose sorgt für das Überleben des Bienenwolfnachwuchses
Bienenwölfe der Gattung Philanthus gehören zu den Grabwespen und jagen - wie der Name nahelegt - Bienen als Nahrungsgrundlage für ihren Nachwuchs. Sie legen Bruthöhlen im Boden an, vergraben dort ihre Beute und legen ihre Eier ab. Um ihren Nachwuchs in den feuchtwarmen Lebensbedingungen im Boden vor Schimmelpilzen zu schützen, sondert das Bienenwolfweibchen aus seinen Antennen eine Substanz ab, die symbiotische Bakterien der Gattung Streptomyces enthält. Diese produzieren einen Cocktail aus verschiedenen antibiotischen Wirkstoffen, der von den Bienenwolflarven in ihren Kokon eingesponnen wird. Diese bereits seit mehr als 68 Millionen Jahren bestehende Schutz-Symbiose sorgt dafür, dass der Bienenwolfnachwuchs gegen schädliche Mikroorganismen gefeit ist.
Anzeichen einer Genomerosion beim bakteriellen Partner
Das Genom der mit dem Europäischen Bienenwolf Philanthus triangulum assoziierten Bakterien Streptomyces philanthi wurde jetzt von einem Team um Martin Kaltenpoth, dem Direktor der neuen Abteilung Insektensymbiose am Max-Planck-Institut für chemische Ökologie, näher untersucht. „Wir fragten uns, ob eine so lange Beziehung mit dem Wirt zu Veränderungen im Genom und der Steuerung aktiver Gene sowie dem Zusammenspiel der Stoffwechselprozesse von Bienenwolf und seinen bakteriellen Partnern geführt hat“, erläutert Mario Sandoval-Calderón, einer der beiden Erstautoren, die Motivation für diese Arbeit.
Mit Hilfe neuester Gensequenzierungsmethoden gelang es den Forschenden, das vollständige Genom des Symbionten auszulesen. Dabei fiel die Anhäufung von „Pseudogenen“ auf, die infolge einer Leserasterverschiebung der kodierenden Basenpaare entstehen. „Diese Frameshift-Mutationen wahrscheinlich inaktivierter Gene sind sichere Hinweise auf eine beginnende Genom-Erosion bei Streptomyces philanthi. Während das Ergebnis einer Genom-Erosion gut charakterisiert ist, ist der Beginn dieses Prozesses weniger gut verstanden. Daher kann uns der Zugang zu einem Organismus im Anfangsstadium des Genomzerfalls helfen zu verstehen, wie es zu einem solchen Prozess kommt“, sagt Studienleiter Martin Kaltenpoth.
Gene: reduziert auf die Schutzsymbiose?
Weitere genetische Analysen deuteten darauf hin, dass der Stoffwechsel der bakteriellen Symbionten hauptsächlich auf die Produktion von antibiotischen Substanzen ausgerichtet ist, die für den Schutz des Bienenwolfnachwuchses notwendig sind. Nicht geklärt werden konnte die Frage, warum die Antibiotika auch in den Antennen der Bienenwolfweibchen produziert werden und dann über die Absonderung einer Substanz, die auch die Bakterien enthält, in die Bruthöhle abgegeben werden. Ihre tatsächliche Schutzfunktion wurde bislang nur auf dem Kokon nachgewiesen. Dafür lieferten die Analysen Hinweise auf bestimmte Aminosäuren, die der Wirt seinen Symbiose-Partnern in den Antennendrüsenreservoirs zuführen muss, weil Streptomyces philanthi diese Nährstoffe selbst nicht mehr herstellen können. Damit hätten Bienenwölfe gar die Kontrolle über die Antibiotika-Produktion und wären in der Lage, den von ihren bakteriellen Partnern erbrachten Nutzen selbst zu regulieren, um den Schutz ihrer Nachkommen zu optimieren. Weitere Analysen müssen diese Vermutung nun weiter untermauern.
Dass dieser Genomzerfall bei den Symbionten erst im Anfangsstadium zu sein scheint, überrascht nach dieser überaus langen Zeit der Partnerschaft mit dem Europäischen Bienenwolf. Daher untersuchen die Wissenschaftlerinnen und Wissenschaftler nun auch die Symbionten-Stämme anderer, verwandter Bienenwolfarten. „Möglicherweise erfahren nur einige Stämme dieser Bakterien eine Genomerosion. Das Verständnis der Gründe dafür und der Faktoren, die diesen Prozess in Gang setzen, könnte uns wertvolle Hinweise über die Kräfte liefern, die die Genomevolution im Allgemeinen steuern,“ hofft Martin Kaltenpoth.
Die modernen Werkzeuge der Molekularbiologie machen es zunehmend möglich, die Wechselwirkungen zwischen Lebewesen von der Ebene der Moleküle bis hin zu ökologischen und evolutionsbiologischen Fragestellungen zu untersuchen - auch in Nicht-Modell-Organismen. Ihre Anwendung auf die vielfältigen Symbiosen zwischen Insekten und ihren bakteriellen Partnern hilft dabei, das Zusammenleben dieser Organismen, ihren gegenseitigen Nutzen sowie ihre Ko-Evolution immer besser zu verstehen.
Max-Planck-Institut für chemische Ökologie
Originalpublikation:
Nechitaylo, T. Y., Sandoval-Calderón, M., Engl, T., Wielsch, N., Dunn, D. M., Goesmann, A., Strohm, E., Svatoš, A., Dale, C., Weiss, R. B., Kaltenpoth, M. (2021). Incipient genome erosion and metabolic streamlining for antibiotic production in a defensive symbiont. Proceedings of the National Academy of Sciences of the United States of America, doi: 10.1073/pnas.2023047118