Das Zikavirus (ZIKV) ist ein Flavivirus, das hauptsächlich durch Aedes-Mücken (auch als Gelbfiebermücke, Denguemücke oder Ägyptische Tigermücke bezeichnet) übertragen wird. Internationale Aufmerksamkeit erregte das Virus im Jahr 2015, als es im Südpazifik sowie in Süd- und Nordamerika zu einer Zikavirus-Epidemie kam. Zikavirus-Infektionen kommen weltweit, jedoch besonders in den Tropen und Subtropen vor. Die asiatische Tigermücke, ein weiterer möglicher Überträger, kommt vereinzelt auch in Deutschland vor. Erste Zikavirus-Übertragungen durch Stechmücken in Europa wurden im Herbst 2019 aus Südfrankreich berichtet.
Eine Zikavirus-Infektion verläuft in den meisten Fällen mild. Gefürchtet ist eine Zikavirus-Infektion jedoch bei Schwangeren, insbesondere im ersten Schwangerschaftsdrittel, weil sie beim Fötus zu Mikrozephalie (zu kleiner Schädel) und anderen Fehlbildungen des Gehirns führen kann. Zudem wurde die Zikavirus-Infektion mit dem Guillain-Barré-Syndrom in Verbindung gebracht. Bisher gibt es keinen Impfstoff und keine spezifischen Therapeutika zur Behandlung einer Zikavirus-Infektion.
Forscherinnen und Forscher des Paul-Ehrlich-Instituts, des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM), der Universitätsklinik Aachen und dem Deutschen Zentrum für Infektionsforschung (DZIF), Braunschweig, unter Leitung von Prof. Eberhard Hildt, Leiter der Abteilung Virologie des Paul-Ehrlich-Instituts, erforschen die Interaktionen zwischen dem Zikavirus und seinem Wirt, dem Menschen. Ein Fokus liegt dabei auf den Wechselwirkungen zwischen dem Zikavirus und dem Restriktionsfaktor Tetherin. Tetherin ist ein durch Interferon induzierbares zelluläres Protein mit antiviralen Eigenschaften gegen ein breites Spektrum umhüllter Viren. So hemmt es deren Freisetzung, indem es sie aneinander und an die Zellmembran heftet. Tetherin ist damit ein wichtiger Bestandteil der angeborenen Immunantwort. Allerdings haben Viren unterschiedliche Strategien entwickelt, um Tetherin zu entkommen.
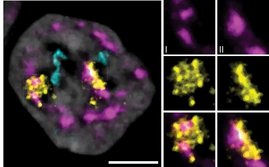
Die Forschungsgruppe untersuchte in Zellkulturen mit unterschiedlichen Zelltypen (HaCat-, A549-, Vero- und HT-1080-Zellen) sowie mit zwei unterschiedlichen Zikavirus-Stämmen („French Polynesia H/PF2013 und Uganda 976), welche Effekte das Zikavirus auf die Expression (Bildung) der Tetherin-Boten-RNA (messenger ribonucleic acid, mRNA) hat. Eine verstärkte Expression der mRNA bedeutet in der Regel eine verstärkte Bildung des Proteins. Umgekehrt untersuchten die Wissenschaftlerinnen und Wissenschaftler, wie Tetherin die Freisetzung des Zikavirus beeinflusst.
Das Team stellte fest, dass es durch eine Zikavirus-Infektion der Zellen zwar zu einer verstärkten Tetherin-mRNA-Expression (Bildung) kommt. Diese verstärkte Expression führte jedoch nicht zu einer erhöhten Tetherin-Proteinkonzentration in den Zellen, was bei der festgestellten verstärkten Transkription des Gens zu erwarten wäre. Vielmehr war die Tetherinkonzentration aufgrund reduzierter Halbwertszeit (die Zeitspanne, bis die Proteinkonzentration auf die Hälfte reduziert ist) sogar verringert. Die experimentellen Daten deuten darauf hin, dass es zu einem lysosomalen Abbau von Tetherin in mit ZIKV infizierten Zellen kommt. Lysosomen sind umschlossene Zellorganellen (Bläschen) in Zellen höherer Organismen, in denen der Abbau von körpereigenen und fremden Substanzen erfolgt. Wurde dagegen der Abbau von Tetherin in Zellen experimentell verhindert, war Tetherin durchaus in der Lage, die Freisetzung und Vermehrung des Zikavirus zu verhindern. Die Hemmung des Tetherin-Abbaus gelang durch Abreicherung des ESCRT-0-Proteins HRS. Der ESCRT-Komplex spielt eine wichtige Rolle bei verschiedenen zellulären Prozessen, wie beispielsweise der Einsortierung von Membranproteinen zum lysosomalen Abbau oder der viralen Umhüllung. Die Fähigkeit des Zikavirus, in infizierten Zellen für einen verstärkten Abbau von Tetherin zu sorgen, ist demnach eine wirksame virale Fluchtstrategie.
Welche Bedeutung haben diese Ergebnisse? Gerade auch im Hinblick auf neu auftretende Viren und der sich in Zeiten der Globalisierung und der globalen Erwärmung weltweit schnell verbreitenden Viren ist es wichtig, antivirale Behandlungsstrategien zu entwickeln, die für möglichst viele unterschiedliche Virustypen nutzbar sind. Therapieansätze, die es dem Menschen ermöglichen, die Immunfluchtstrategien (Immun-Escape) der Viren auszuhebeln und sie dadurch erfolgreich zu bekämpfen, kommen diesem Ziel nach. In jüngerer Zeit werden zur Bekämpfung von Virusinfektionen unter anderem Hemmstoffe des Fibroblasten-Wachstumsfaktors (fibroblast growth factor, FGF) diskutiert. FGF beeinträchtigt die Interferonantwort, die wiederum eine wichtige Säule in der Infektionsabwehr ist. Die aktuellen Ergebnisse weisen jedoch auf die Diskrepanz einer erhöhten Genstimulation (verstärkte mRNA-Transkription) und der nachgeschalteten Funktionalität hin. Ein antiviraler Ansatz könnte daher die gezielte Hemmung des Abbaus dieser Interferon-induzierten Proteine sein, um dadurch ihre antivirale Wirksamkeit zu ermöglichen. Die Hemmung des oben beschriebenen Proteins HRS könnte eine weitere antivirale Strategie sein.
Paul-Ehrlich-Institut
Originalpublikation:
Herrlein ML, Schmanke P, Elgner F, Sabino C, Akhras S, Bender D, Glitscher M, Tabari D, Scholl C, Stingl J, Hildt E (2021): Catch me if you can - the crosstalk of ZIKV and the restriction factor Tetherin. J Virol Dec 22, DOI: https://doi.org/10.1128/jvi.02117-21