Als Vertreter der Weichtiere häuten sich Käferschnecken – im Gegensatz zu Insekten und Krebsen – nicht. Käferschnecken fühlen sich also wahrlich wohl in ihrer Haut. Dennoch besitzen Käferschnecken viele Signalmoleküle, die bis vor kurzem nur mit Häutungsprozessen in Verbindung gebracht wurden. "Wir gehen inzwischen davon aus, dass die ursprünglichen Funktionen dieser 'Häutungsmoleküle' andere sind", erklärt Studienleiter Andreas Wanninger von der Unit Integrative Zoologie am Department für Evolutionsbiologie der Fakultät für Lebenswissenschaften. Doch welche sind die Funktionen dieser Moleküle? Und wo sind die entsprechenden Gene aktiv?
Häutung keine Voraussetzung für Häutungsmoleküle
Die Gene, welche die Häutungsmoleküle codieren, sind in vielen Tieren besonders während der Metamorphose stark aktiv – also während der Umwandlung von der Larve zum Adultstadium. Das hat Elisabeth Zieger, Postdoktorandin in der Forschungsgruppe von Andreas Wanninger, bereits in einer früheren Studie aufgezeigt (Zieger et al. 2020). "Unsere ersten Ergebnisse deuteten bereits darauf hin, dass Häutungsmoleküle auch in Tieren, die sich nicht häuten, eine zentrale Rolle für wichtige Entwicklungsschritte spielen. Als Nächstes wollten wir daher wissen, in welchen Zellen bzw. Geweben Häutungsgene aktiv sind", erläutert Elisabeth Zieger den Ansatz ihres Projekts.
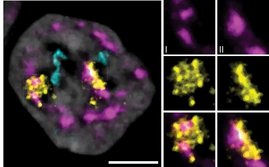
Dabei kommt eine molekularbiologische Methode namens in-situ-Hybridisierung zum Einsatz: All jene Zellen werden gefärbt, in denen ein zu untersuchendes Gen exprimiert, also aktiv ist. Die Forscher*innen haben sich genau angesehen, wie sich die Verteilung der Genaktivität im Laufe der Entwicklung verändert – von der 0.25 mm großen, freischwimmenden Larve zum kriechenden Juveniltier.
Wann und wo die Häutungsgene aktiv sind
In den frühen Larvenstadien konnten die Wissenschafter*innen zunächst keine Aktivität von Häutungsgenen in ihrem Forschungsobjekt, der Käferschneckenart Acanthochitona fascicularis, nachweisen. Erst kurz vor Beginn der Metamorphose haben sie Häutungsgene in bestimmten Sinneszellen an der Körperoberfläche der Larven entdeckt. Ein Großteil dieser Zellen verschwand nach Abschluss der Metamorphose wieder. Die Schlussfolgerung: eine sensorische Funktion während des Übergangs von der Larve zum Juveniltier.
"Eine spannende Entdeckung für uns", kommentiert Andreas Wanninger diese Ergebnisse. Wie eine winzige Larve inmitten eines gigantischen Ozeans weiß, wann und wo sie sich niederlassen soll, sei "von großer ökologischer Bedeutung" und noch immer "ein Mysterium für die Biologie", so Wanninger. In der Vergangenheit wurden bereits viele Reize aus der Umwelt als Auslöser für larvale Metamorphosen identifiziert. Dazu gehören vor allem chemische Reize. Aber wie und mittels welcher Sinnesorgane diese Reize in den jeweiligen Tieren aufgenommen und verarbeitet werden, war bis dato weitestgehend unklar.
Metamorphose – abhängig von Umweltsignalen
"Die Reize sind von Art zu Art verschieden", erklärt Elisabeth Zieger. "Unter natürlichen Bedingungen, also im Lebensraum der Tiere, können viele unterschiedliche Faktoren und Signale zusammenkommen. Welche nun aber entscheidend für das Auslösen der Metamorphose sind und welche Organsysteme daran beteiligt sind ist äußerst schwierig zu untersuchen."
Die neuen Resultate der Zoolog*innen suggerieren, dass viele Tiergruppen die gleichen endogenen – also körpereigenen – Häutungsmoleküle verwenden. Dadurch kontrollieren sie ihre Metamorphose abhängig von diversen Umweltsignalen. "Wir hoffen, dass weitere Forschung in diese Richtung uns dabei helfen kann, die Ausbreitung und Etablierung mariner Tierarten besser zu verstehen ", meint Zieger.
(Universität Wien)
Publikation:
Zieger, E., Calcino, A. D., Robert, N. S. M., Baranyi, C., Wanninger, A. (2021) Ecdysis-related neuropeptide expression and metamorphosis in a non-ecdysozoan bilaterian. In: Evolution 15.7.2021; DOI: 10.1111/evo.14308
Zieger, E., Robert, N. S. M., Calcino, A.D., Wanninger, A. (2020). Ancestral role of ecdysis-related neuropeptides in animal life cycle transitions. In: Current Biology 31:1–7. DOI: 10.1016/j.cub.2020.10.004