JAGN1 als Player für das Immunsystem
Das Forschungsteam rund um Josef Penninger konnte nun die Rolle eines bestimmten Gens für die Produktion von Antikörpern beschreiben, und stützte sich dabei auf Daten von PatientInnen, die an einer seltenen genetischen Krankheit leiden. Möglich wurde dies durch eine Kooperation mit dem Team um Christoph Klein am Haunerschen Kinderspital in München. Bereits 2014 wurde das Gen JAGN1 von den Teams um Klein und Penninger als wichtiger Player im Immunsystem identifiziert. Ist JAGN1 defekt, kommt es bei Betroffenen zu einer Fehlfunktion wichtiger weißer Blutkörperchen, den sogenannten neutrophilen Granulozyten, und somit zu einer schweren angeborenen Immunschwäche. PatientInnen leiden häufig unter gravierenden Infektionen, weil sich ihr Körper nicht ausreichend gegen Bakterien- und Pilzinfektionen wehren kann.
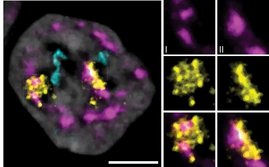
In der aktuellen Studie beleuchteten die ForscherInnen nun die Rolle von JAGN1 für die sogenannten B-Zellen. Wenn B-Zellen körperfremde Substanzen erkennen, sind sie in der Lage, sich in Plasmazellen zu entwickeln. Jede Plasmazelle kann dann pro Sekunde Tausende von spezifischen Antikörpern ausscheiden. Diese Massenproduktion findet an einem bestimmten Ort in der Zelle, im sogenannten Endoplasmatischen Retikulum statt. Anschließend werden die fertig gebauten Antikörper in einer bestimmten Region mit Zuckermolekülen „verziert“. Dieser Prozess der sogenannten Glykosylierung dient allerdings nicht der Dekoration, sondern erleichtert den Antikörper die Bindung zu anderen Immunzellen, um die Abwehrreaktion des Körpers zu verstärken. Denn charakteristische Zuckerstrukturen, die an Proteine angeheftet werden, haben Auswirkungen auf die Protein-stabilität und die Kommunikation zwischen Zellen und deren Umgebung.
Seltener Gendefekt liefert grundlegendes Wissen über Antikörper
"Als wir JAGN1 in B-Zellen von Mäusen außer Gefecht setzten, konnten wir eine drastische Reduktion der Antikörper messen. Auch die typischen Zuckersignaturen, die auf den Antikörper sitzen, hatten sich verändert. JAGN1 beeinflusst die Antikörper-Fabriken in den Zellen", erklärt die Wissenschaftlerin Astrid Hagelkrüys, Erstautorin der aktuellen Publikation. „Zu unserer Überraschung führt diese Veränderung der Zuckerstrukturen der aber auch zu einer besseren Bindungsfähigkeit der Antikörper an andere Immunzellen und verstärkt die Abwehrreaktion.“ Auch in menschlichen Proben konnten die WissenschaftlerInnen diesen Mechanismus nachweisen. „Seltene Gendefekte betreffen zwar nur wenige Menschen, aber manchmal lassen sich daraus grundlegende Prinzipien der Biologie ableiten. In diesem Fall konnten wir nachweisen, dass ein bestimmtes Gen auf das Endoplasmatische Retikulum wirkt und daher für die Massenproduktion von Antikörpern essentiell ist. Gleichzeitig haben wir auch herausgefunden, dass die „Zuckerhülle“ von Antikörpern verändert wird, was eine wichtige Auswirkung darauf hat, wie solche Antikörper im Körper tatsächlich funktionieren", sagt Josef Penninger, Direktor des Life Science Institut der University of British Columbia, der nach wie vor eine Forschungsgruppe am IMBA leitet.
IMBA
Originalpublikation:
Hagelkruys et al.: A crucial role for Jagunal homolog 1 in humoral immunity and antibody glycosylation in mice and humans, Journal of Experimental Medicine, 2020. doi: 10.1084/jem.20200559