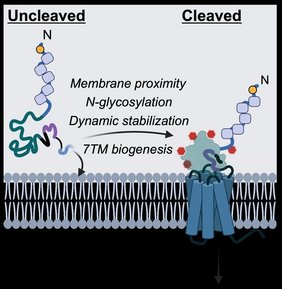
Die Selbstspaltung fungiert dabei als eine Art eingebaute Qualitätskontrolle: Nur korrekt gespaltene Rezeptoren dürfen die „Zellfabrik“ verlassen und die Oberfläche erreichen. Die Studie wurde gerade im Fachjournal „Nature Communications“ veröffentlicht.
Zellen überwachen ständig ihre Umgebung und nehmen chemische und mechanische Signale wahr, die lebenswichtige Funktionen wie Bewegung, Wachstum und Kommunikation steuern. Die Adhäsions-G-Protein-gekoppelten Rezeptoren – eine besondere Familie von Oberflächenmolekülen – fungieren als mechanische Kraftsensoren und spielen eine Schlüsselrolle in Prozessen, die vom Muskelwachstum bis zur Vernetzung des Gehirns reichen. Eine fehlerhafte Aktivität von aGPCRs kann schwere Krankheiten wie Allergien, Schizophrenie und Krebs auslösen.
Die Forschenden um Prof. Dr. Tobias Langenhan von der Medizinischen Fakultät der Universität Leipzig und Prof. Dr. Andrea Sinz vom Institut für Pharmazie der Martin-Luther-Universität Halle-Wittenberg entdeckten, dass ein anderer Teil des Rezeptors, die sogenannte Sieben-Transmembran-Region (7TM), eine entscheidende unterstützende Rolle bei der Spaltung spielt. Sie stabilisiert nicht nur die GAIN-Domäne, sondern hilft auch dabei, sie korrekt innerhalb der proteinbildenden Maschinerie der Zelle zu positionieren. Darüber hinaus identifizierten die Teams Helfermoleküle in der Zelle, die während dieses Prozesses mit dem Rezeptor interagieren. Dazu gehören Enzyme, die dem neu gebildeten Protein Zuckergruppen hinzufügen.
„Zusammen sorgen diese Faktoren dafür, dass die Selbstspaltung des Rezeptors effizient abläuft. Bemerkenswert ist, dass Rezeptoren, die sich nicht spalten können, in der Zelle zurückgehalten werden können und nicht an die Oberfläche gelangen, wo sie benötigt werden, um Signale aus der Außenwelt zu empfangen“, erklärt Prof. Dr. Tobias Langenhan. Diese Erkenntnisse legen nahe, dass die Selbstspaltung eine eingebaute Qualitätskontrolle innerhalb der Zelle ist. Dieser Befund eröffnet neue Forschungsansätze dazu, wie dieser Kontrollpunkt umgesetzt wird und welche Rolle er bei der Entwicklung von Krankheiten spielt.
Diese Forschungsergebnisse gingen aus einem gemeinsamen Projekt innerhalb des Sonderforschungsbereiches 1423 (SFB) „Strukturelle Dynamik der GPCR-Aktivierung und -Signaltransduktion“ hervor. Der SFB1423 ist eine von der Deutschen Forschungsgemeinschaft (DFG) geförderte, vierjährige Forschungseinrichtung, an der fünf Fördereinrichtungen beteiligt sind: die Universität Leipzig, die Martin-Luther-Universität Halle-Wittenberg, die Charité – Universitätsmedizin Berlin, die Heinrich-Heine-Universität Düsseldorf und die Universitätsklinik Mainz. Forschende aus biochemischen, biomedizinischen und computerwissenschaftlichen Kontexten arbeiten über die Grenzen ihrer jeweiligen Institutionen und Disziplinen hinweg zusammen, um ein umfassendes Verständnis der Auswirkungen der Strukturdynamik auf die Funktion des GPCR zu erhalten.
Universität Leipzig
Originalpublikation:
Chung, Y.K., Ihling, C.H., Zielke, L. et al. Self-cleavage of the GAIN domain of adhesion G protein-coupled receptors requires multiple domain-extrinsic factors. Nat Commun16, 8736 (2025). doi.org/10.1038/s41467-025-64589-3