Vor rund fünf Jahren stellte Institutsleiter Prof. Dr. William (Bill) Martin mit seinem Team den letzten gemeinsamen universellen Vorfahren aller Lebewesen vor und taufte ihn „LUCA“. Er lebte vor ca. 3,8 Milliarden Jahren an heißen Tiefseehydrothermalquellen.
Nun beschreiben die Düsseldorfer Evolutionsbiologinnen und -biologen eine weitere sehr alte Zelle und geben ihr den Namen „LBCA“ („Last Bacterial Common Ancestor“). Sie ist der Vorfahr der heute größten Domäne aller lebenden Organismen: der Bakterien. In Communications Biology berichten sie über ihre neuen Forschungsansätze, die zu dem Erfolg geführt haben, über LBCAs Biochemie und die stammesgeschichtlichen (phylogenetischen) Zusammenhänge.
Bakterien sind fast so alt wie das Leben selbst: LBCA lebte vor rund 3,5 Milliarden in einer ähnlichen Umgebung wie schon LUCA. Um das Erbgut, die Eigenschaften und die Lebensumstände von LBCA zu enträtseln, untersuchte das Forschungsteam das Genom von 1089 bakteriellen Anaerobien – Bakterien, die ohne Sauerstoff leben. „Die Beschränkung auf Anaerobien vereinfachte unsere Arbeit“, so Erstautorin Dr. Joana C. Xavier. „Da Bakterien entstanden, als es auf der Erde keinen freien Sauerstoff gab, mussten wir uns nicht ansehen, wie sich Bakterien heute den Sauerstoff nutzbar machen. Denn diese Mechanismen entwickelten sich evolutionsgeschichtlich erheblich nach den ersten Bakterien.“
Bei höheren Lebewesen wird das Erbgut über den Vererbungsweg (vertikaler Gentransfer) von Eltern- zu Kindergeneration weitergebenen. Daher gibt das Genom auch Aufschluss über die stammesgeschichtliche Entwicklung. Bei Bakterien spielt aber eine andere Form des Erbgutaustausches eine bedeutende Rolle, der sogenannte laterale Gentransfer (LGT). Über ihn können Bakterien – auch über Artgrenzen hinweg – Erbinformationen untereinander austauschen. Dies erschwerte die Rekonstruktion des LBCA-Genoms erheblich, denn mit den traditionellen Methoden der Phylogenetik kann nicht auf die Wurzel des bakteriellen Evolutionsbaums zurückgeschlossen werden.
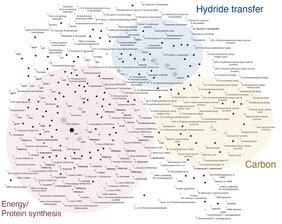
Die Düsseldorfer Evolutionsforscherinnen und -forscher verwendeten deshalb biochemische Netzwerke zusammen mit Tausenden von einzelnen Stammbäumen. Anhand der 1089 untersuchten Anaerobien-Genome identifizierten sie 146 Proteinfamilien, die in allen Bakterien vorhanden sind. Diese Proteine bilden ein nahezu vollständiges metabolisches Kernnetzwerk.
Um das Genom von LBCA zu vervollständigen, mussten nur neun weitere Gene hinzugenommen werden, damit das metabolische Netzwerk des Urbakteriums alle essentiellen und universellen Stoffwechselprozesse enthält. Einige weitere Gene – die von LUCA stammen – sind zudem noch notwendig, damit der Organismus völlig unabhängig ist und sich fortpflanzen kann.
Nachdem sie das Stoffwechselnetzwerk von LBCA entschlüsselt hatten, suchten die Autoren mit statistischen Verfahren nach heute lebenden Bakteriengruppen, die ihrem Urahnen am ähnlichsten sind. Die dazu verwendete Methode „Minimal Ancestor Deviation“ (kurz MAD) hatte Co-Autor Fernando D. K. Tria entwickelt: „Die modernen Clostridien sind die ähnlichsten Verwandte von LBCA, dicht gefolgt von den Deltaproteobacteria, Actinobacteria und einigen Mitgliedern von Aquifex. Gemeinsam haben diese Gruppen den sogenannten Acetyl-CoA-Weg, mit dem sie Kohlenstoff fixieren.“
Dazu Prof. Martin, Seniorautor der Studie: „Dies ist der einzige Weg zur Kohlenstofffixierung, der sowohl in Archaeen als auch in Bakterien vorkommt und der auf LUCA zurückgeht. Dieses unabhängig gewonnene Ergebnis bestätigt auch unsere jüngsten Erkenntnisse über den Ursprung und die frühe Entwicklung des Lebens in hydrothermalen Schloten.“
„Wir können mit Sicherheit ableiten, dass LBCA eine stäbchenförmige Gestalt hatte“, so Xavier. „Und wenn es Clostridien ähnlich war, war LBCA möglicherweise in der Lage, Sporen zu bilden.“ Diese Hypothese wurde kürzlich von anderen Forschern aufgestellt „und sie ist sehr gut mit unseren Ergebnissen vereinbar", betont Xavier. Mittels Sporen hätten die den frühen Zellen in der unwirtlichen Umgebung der frühen Erde überleben können.
Schließlich untersuchten die Autoren auch, wieweit der laterale Gentransfer schon zu Zeiten von LBCA eine Rolle spielte. Fernando D. K. Tria: „LBCA unterscheidet sich maßgeblich von durchschnittlichen heutigen Bakterien, denn die LBCA-Gene wurden vor allem durch Vererbung – den vertikalen Gentransfer – weitergegeben.“
(Heinrich-Heine-Universität Düsseldorf)
Originalpublikation:
Xavier, J.C., Gerhards, R.E., Wimmer, J.L.E. et al., The metabolic network of the last bacterial common ancestor, Commun Biol 4, 413 (2021).
DOI: 10.1038/s42003-021-01918-4