Die Wissenschaftlerinnen und Wissenschaftler haben in ihrer Studie die sogenannten Kupffer-Zellen untersucht. Diese gehören zu den Makrophagen, einer wichtigen Gruppe von Fresszellen, und zählen zu den Abwehrtruppen des angeborenen Immunsystems. Während der Entwicklung des Embryos wandern sie in seine Leber ein, wo sie dann dauerhaft residieren. Dort bekämpfen sie etwa Krankheitserreger und verdauen überalterte Zellen.
„Die Kupffer-Zellen übernehmen aber auch die Rolle eines Dirigenten“, erklärt Prof. Dr. Elvira Mass vom LIMES-Institut der Universität Bonn. „Sie instruieren die Leberzellen um sie herum, was diese zu tun haben. Sie sorgen so dafür, dass dieses zentrale Stoffwechsel-Organ seine vielfältigen Aufgaben korrekt erfüllen kann.“
Beethoven statt Vivaldi
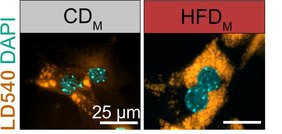
Offenbar ist es diese Dirigenten-Funktion, die durch Fettleibigkeit verändert wird. In diese Richtung deuten zumindest Maus-Experimente, die Mass zusammen mit anderen Arbeitsgruppen der Universität Bonn durchgeführt hat. „Wir konnten zeigen, dass die Nachkommen übergewichtiger Muttertiere häufig kurz nach der Geburt eine Fettleber entwickelten“, erläutert Mass‘ Mitarbeiter Dr. Hao Huang. „Und zwar selbst dann, wenn sich die Jungtiere ganz normal ernährten.“
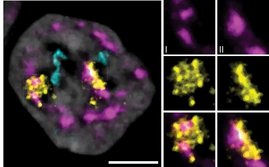
Grund für diese Störung war offenbar eine „Umprogrammierung“ der Kupffer-Zellen in den Jungtieren. Sie gaben dadurch molekulare Signale ab, mit denen sie die Leberzellen anwiesen, vermehrt Fette aufzunehmen. Bildlich gesprochen, dirigierten sie nicht länger eine Beethoven-Symphonie, sondern ein Stück von Vivaldi.
Diese Umstellung erfolgte offenbar bereits während der Embryonalentwicklung, ausgelöst durch Stoffwechselprodukte der Mutter. Sie betätigten in den Kupffer-Zellen eine Art molekularen Schalter, wodurch diese ihr Dirigat langfristig umstellten. „Bei diesem Schalter handelt es sich um einen sogenannten Transkriptionsfaktor“, sagt Mass. „Er steuert, welche Gene in den Kupffer-Zellen abgelesen werden.“
Ohne molekularen Schalter keine Fettleber
Wenn die Forschenden diesen Schalter in den Kupffer-Zellen während der Schwangerschaft genetisch entfernten, entwickelten die Jungtiere keine Fettleber. Ob er auch einen Ansatzpunkt für Medikamente bietet, ist noch unklar. Die beteiligten Arbeitsgruppen wollen dieser Frage nun in Folgestudien nachgehen.
Falls daraus neue Behandlungsmöglichkeiten entstehen, wäre das eine gute Nachricht. Denn der veränderte Arbeitsmodus der Kupffer-Zellen hat vermutlich vielfältige negative Auswirkungen. So geht die Verfettung der Leber mit massiven Entzündungsreaktionen einher. Sie sorgen dafür, dass immer mehr Leberzellen absterben und durch Bindegewebe ersetzt werden. Folge ist eine sogenannte Fibrose, bei der die Leber ihre Funktion nach und nach einstellt. Gleichzeitig steigt dadurch das Risiko, dass Leberzellen entarten und Tumoren bilden.
„Es wird immer deutlicher, dass viele Erkrankungen des Menschen bereits sehr früh im Laufe der Entwicklung entstehen“, sagt Mass, die auch Sprecherin des Transdisziplinären Forschungsbereichs „Life & Health“ und Vorstandsmitglied im Exzellenzcluster „ImmunoSensation2“ der Universität Bonn ist. „Unsere Studie ist eine der wenigen, die im Detail einen Weg aufklären konnten, auf dem das geschieht.“
Beteiligte Institutionen und Förderung:
An der Studie waren neben der Universität Bonn das Deutsche Zentrum für Neurodegenerative Erkrankungen (DZNE) sowie die Universitäten Wien (Österreich), Ghent (Belgien) und Shanghai (China) beteiligt. Die Arbeiten wurden durch die Deutsche Forschungsgemeinschaft (DFG, insbesondere SFB 1454 Metaflammation), das European Research Council (ERC), die Jürgen-Manchot-Stiftung, den Boehringer Ingelheim Fonds sowie die European Molecular Biology Organization (EMBO) unterstützt.
(Rheinische Friedrich-Wilhelms-Universität Bonn)
Originalpublikation:
Hao Huang et al.:
Kupffer cell programming by maternal obesity triggers fatty liver disease;
Nature; DOI: 10.1038/s41586-025-09190-w, URL: https://www.nature.com/articles/s41586-025-09190-w