Der Zebrafisch dürfte vielen Aquarienfreunden vor allem durch seine auffällige Pigmentierung bekannt sein. Die charakteristischen schwarzblauen Streifen, denen das Tier seinen Namen verdankt, bilden sich allerdings erst im Laufe der Zeit. Seine wimperngroßen Larven sind dagegen noch mehr oder weniger durchsichtig. Viele Vorgänge in ihrem Körper lassen sich deshalb unter dem Lichtmikroskop beobachten. Daher dienen sie heute Forschungsgruppen rund um den Globus als Modellorganismus.
„An der Universität Bonn untersuchen wir etwa, wie Zebrafische defektes Nervengewebe reparieren“, erklärt Prof. Dr. Benjamin Odermatt vom Anatomischen Institut des Universitätsklinikums Bonn. „Das interessiert uns auch deshalb, weil viele Gene, die an diesem Prozess beteiligt sind, in ähnlicher Form auch beim Menschen existieren.“ Im Prinzip könnten Wirkstoffe, die diese Reparatur-Gene im Fisch ankurbeln, somit auch im Menschen funktionieren. Oft sind die Unterschiede zwischen den Erbanlagen von Fisch und Mensch dazu aber dann doch zu groß. Für die Suche nach neuen Medikamenten eignen sich die Larven daher nur eingeschränkt.
Fisch-Gen durch Menschen-Gen ersetzt
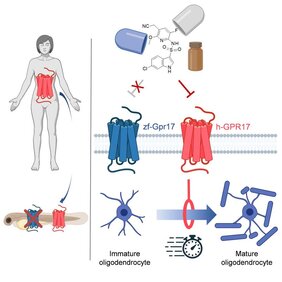
„Wir haben deshalb einen anderen Weg beschritten“, erklärt Prof. Dr. Evi Kostenis vom Institut für Pharmazeutische Biologie der Universität Bonn. „Wir haben zu einem menschlichen Gen, das dort bei der Reparatur von Nervenzellen eine Rolle spielt, sein Pendant im Zebrafisch gesucht. Dann haben wir dieses Pendant ausgeschnitten und durch die Version aus dem Menschen ersetzt.“ Die neue Erbanlage übernahm dort die Funktion des ursprünglichen Zebrafisch-Gens. „Wenn wir nun eine Substanz finden, die in dem Fisch mit dem Menschen-Gen die Reparaturprozesse ankurbelt, bestehen große Chancen, dass das auch im Menschen so sein wird“, sagt die Wissenschaftlerin, die auch Mitglied im Transdisziplinären Forschungsbereich „Leben und Gesundheit“ der Universität Bonn ist.
Dass das funktioniert, haben die Forschenden in ihrer Pilotstudie am sogenannten GPR17-Rezeptor demonstriert. Im Menschen kann seine Überaktivierung zu Krankheiten wie Multipler Sklerose (MS) führen. Nervenzellen kommunizieren mithilfe elektrischer Signale. Ihre Ausläufer sind dazu von einer Art Isolierschicht umgeben, einer fettähnlichen Substanz namens Myelin. Sie verhindert Kurzschlüsse und beschleunigt zusätzlich erheblich die Weiterleitung der Reize. Erzeugt wird diese schützende Hülle von speziellen Zellen, den Oligodendrozyten. Diese ähneln einem mikroskopisch kleinen Kraken: Von ihrem Zellkörper gehen sehr viele lange Ärmchen aus, die größtenteils aus Myelin bestehen. Wie ein Isolierband wickeln sich diese bei der Entwicklung des Gehirns um die Nervenzell-Fortsätze. Normalerweise hält die schützende Schicht ein Leben lang.
Isolierband-Spender bleiben in unreifem Zustand
Bei Multipler Sklerose zerstört jedoch das körpereigene Immunsystem diese Myelinschicht. Folge sind neurologische Störungen, etwa beim Sprechen, Sehen oder Gehen. Doch normalerweise gibt es im Gehirn für Reparaturarbeiten einen Vorrat unreifer Oligodendrozyten. Bei einem Schaden reifen sie heran und flicken das Loch. Bei der Multiplen Sklerose ist dieser Mechanismus gestört – viele der zellulären Isolierband-Spender verbleiben in ihrem unfertigen Zustand. Der GPR17-Rezeptor scheint daran die Hauptschuld zu tragen: Wird er durch ein molekulares Signal aktiviert, bremst er die Reifung der Oligodendrozyten.
„Auch Zebrafische verfügen über einen GPR17-Rezeptor“, erklärt Dr. Jesus Gomeza, der die Studie zusammen mit Kostenis und Odermatt geleitet hat. „Und auch dort reguliert er, wie viele Oligodendendrozyten heranreifen.“ Die Forschenden ersetzten nun einen Teil des Rezeptor-Gens durch sein menschliches Pendant – nämlich genau die Struktur, die für den Empfang molekularer Signale zuständig ist. „Wir konnten zeigen, dass dieses neue Gen in den Fischlarven ganz normal funktioniert“, sagt Gomeza. Ein Molekül, das im Reagenzglas den menschlichen GPR17-Rezeptor hemmt, kurbelte zudem in den veränderten Fischen die Bildung reifer Oligodendrozyten an.
Bei der Suche nach neuen Wirkstoffen erprobt man die Substanzen zunächst in Zellkulturen. Nur einzelne, sehr vielversprechende Kandidaten werden dann an Mäusen oder anderen Säugetieren getestet. Doch selbst wenn sie dort funktionieren, enden Tests im Menschen dennoch oft ernüchternd. „Humanisierte Zebrafischlarven erlauben es, rasch viele Substanzen zu screenen, und das mit hoher Erfolgschance, da die Zielgene ja aus dem Menschen stammen“, erklärt Benjamin Odermatt. „Aus unserer Sicht ist das ein sehr vielversprechender Weg für die Wirkstoffentwicklung.“
Universität Bonn
Originalpublikation:
Felix Häberlein et. al.: Humanized zebrafish as a tractable tool for in vivo evaluation of pro-myelinating drugs; Cell Chemical Biology (2022), https://doi.org/10.1016/j.chembiol.2022.08.007