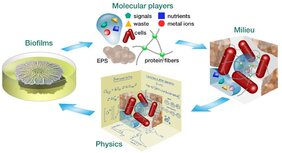
Seit über 50 Jahren drehte sich die Biofilm-Forschung um die biologischen Prozesse, die es Biofilmen ermöglichen, sich zu entwickeln und gegenüber Antibiotika tolerant zu werden. In einem neuen Perspektive-Manuskript, veröffentlicht in der Zeitschrift „Proceedings of the National Academy of Sciences“ (PNAS)*, teilen Wissenschaftler*innen des Max-Planck-Zentrums für Physik und Medizin (MPZPM), Erlangen, in Zusammenarbeit mit Partner*innen der Hebrew University of Jerusalem und der Harvard Medical School, Boston, ihre Einblicke, wie Bakterien physikalische Prozesse nutzen, um Biofilme zu formen und zu erhalten, sogar unter extremen Stressbedingungen. Diese Arbeit unterstreicht, dass biophysikalische Interaktionen, eine wichtige Rolle in bakteriellen Lebenszyklen und Infektionen spielen, in Ergänzung zu biomolekularen Details der Signalübertragung und Regulierung.
Biofilme als Gewebe
“Die Biofilm-Forschung hat sich von der Wahrnehmung des Bakteriums als einzelne Zelle (wie es ursprünglich Antonie van Leewenhawk entdeckte) zu der Erkenntnis entwickelt, dass Bakterien sich unter den richtigen Umständen zu Zellgruppen anhäufen und Biofilme ausbilden“, teilt Prof. Roberto Kolter (Harvard Medical School, Boston, USA) mit. Ein aktueller Fortschritt in Biofilm-Forschung ist deren Vergleich mit menschlichem Gewebe, hinsichtlich der Komplexität und Heterogenität. Teilweise werden Biofilme sogar als dauerhafter Bestandteil menschlichen Gewebes angesehen, beispielsweise bei oralen Biofilmen auf unseren Zähnen oder dem Mikrobiom im menschlichen Darm.
Eine bemerkenswerte Eigenschaft von Biofilmen, die sie mit eukaryotischem Gewebe gemein haben, ist, dass sich Bakterien in die von ihnen selbst sekretierte extrazelluläre polymerische Matrix einbetten. Diese hält die Zellen zusammen, verleiht den Biofilmen mechanische Stabilität, dient als Wasser- und Nährstoffreservoir und schützt vor antimikrobiellen Wirkstoffen. Prof. Liraz Chai (Hebrew University of Jerusalem, Jerusalem, Israel und Max Planck Queensland Centre, Queensland University of Technology, Brisbane, Australien) empfiehlt: „Wir ermutigen dazu, die Diskussion von der extrazellulären Matrix auf den extrazellulären Raum auszuweiten. Die extrazelluläre Matrix ist eine einzelne Komponente in einem einzigartigen Milieu. In diesem kann sie sich mit Wasser und gelösten Nährstoffen, Signalmolekülen, Abfallprodukten und Metallionen vollsaugen. Innerhalb des Milieus beeinflusst eine weite Spanne physikalischer Prozesse direkt die Physiologie des Biofilms: Moleküle und Bakterien beeinflussen sich wechselseitig.“
Wo sich die Physik entfaltet
Wasser ist unerlässlich für alle lebenden Organismen und dominiert den extrazellulären Raum in Biofilmen. Durch Osmose kann die extrazelluläre Matrix Wasser aus der Umgebung aufsaugen und hilft Biofilmen sich auszudehnen, ähnlich wie bei einem Schwamm. Die Verdunstung von Wasser auf den Oberflächen der Biofilme kann die Wasserströme antreiben, die neue Nährstoffe mit sich bringen, so wie wenn Wasser auf den Blättern von Pflanze verdunstet. Biofilme sind teilweise sogar in der Lage, gefäßähnliche Kanäle zu formen, die den Wasserstrom dorthin lenken, wo er am meisten gebraucht wird. Wenn Wasser knapp wird, können Biofilme als Reaktion auf den Austrocknungsstress dieses im extrazellulären Raum zurückhalten. Sie können sogar ihre extrazellulären Polysaccharid-Komponenten in den physikalischen Glaszustand versetzen – eine Strategie, die von austrocknungstoleranten Pflanzensamen und Wasserbären (Bärtierchen) bekannt ist.
Neben Wasser unterstützt der extrazelluläre Raum molekulare Selbstorganisationsprozesse. Beispielsweise formen Proteine Komplexe, während die Anhäufung von Mineralen, die durch die organische, extrazelluläre Matrix bedingt wird, zur Biomineralisierung von Biofilmen führen kann, wie bei der Bildung von harter Plaque auf der Zahnoberfläche.
Wie man die Physik kontrolliert
Eine der spannenden zukünftigen Forschungsrichtung, die in dem Artikel vorgeschlagen wird, ist zu verstehen, wie die physikalischen Prozesse im extrazellulären Raum auf genetischem Level innerhalb der eingebetteten Bakterien reguliert werden. Die Autor*innen argumentieren, dass die Regulationswege, die zur Matrixsekretion führen, relativ gut verstanden sind. Wie jedoch die Abfolge der Ereignisse bei der Matrixproduktion in Abhängigkeit von der Mikroumgebung der Zelle orchestriert wird, und wie sie sich als Reaktion auf äußere Störungen verändern könnte, ist eine ungeklärte Frage. „Dennoch könnten sehr fundamentale physikalische Prozesse der Schlüssel zum Verständnis dieser komplexen hierarchischen Raum-Zeit-Organisation sein, die von der Nanometerskala einzelner Proteine bis hin zu ganzen Biofilmen im Zentimeterbereich reicht“, erklärt Prof. Vasily Zaburdaev (Friedrich-Alexander-Universität Erlangen-Nürnberg und Max-Planck-Zentrum für Physik und Medizin, Erlangen).
Max-Planck-Zentrum für Physik und Medizin
Originalpublikation:
Liraz Chai, Vasily Zaburdaev, and Roberto Kolter: “How bacteria actively use passive physics to make biofilms”, Proceedings of the National Academy of Sciences (PNAS), DOI: https://doi.org/10.1073/pnas.2403842121