Wenn zwei Zellen miteinander „sprechen“, tun sie das unter anderem über winzige Kanäle, die elektrischen Synapsen. Anders als chemische Synapsen ermöglichen diese sogenannten Gap Junctions den direkten Austausch von Informationen zwischen zwei Zellen, etwa in Form von Ionen. Ohne sie könnte unser Herz nicht synchron schlagen, und Nervenzellen könnten nicht im Takt feuern. Doch was genau passiert bei dieser Form der Zellkommunikation?
Ein Blick in die lebende Zelle
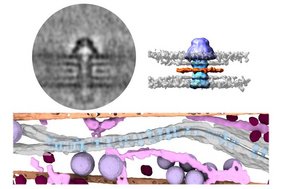
Bisher wurden Gap Junctions vor allem in Form isolierter, chemisch behandelter Proteine untersucht – also außerhalb ihrer natürlichen Umgebung. Um die Struktur direkt in lebendem Gewebe abzubilden, untersuchten Wissenschaftler*innen von Goethe-Universität Frankfurt, Max-Planck-Institut für Biophysik und National Centre for Biological Sciences in Bangalore (Indien) Zellen des Fadenwurms Caenorhabditis elegans mittels Cryo-Elektronentomographie (cryo-ET). „Mit dieser Methode können wir die Zellen in ihrem natürlichen Zustand einfrieren und dreidimensionale Bilder ihres Innenlebens aufnehmen“, erklärt Prof. Dr. Alexander Gottschalk vom Institut für Biophysikalische Chemie an der Goethe-Universität. „Aus Tausenden einzelner Kanalbilder ermitteln wir dann eine hochauflösende Struktur, die Aufschluss über die Funktionsweise der Gap Junctions gibt.“
Die Gap Junction-Kanäle des Fadenwurms bestehen aus je sechs Bausteinen pro Zelle. Zusammen bilden sie einen Kanal aus zwölf Untereinheiten, genau wie beim Menschen. Diese Strukturen sind während der Evolution erstaunlich gut erhalten geblieben, so dass Forschungsergebnisse aus einfachen Organismen auch auf höhere Säugetiere übertragen werden können. Die Ergebnisse zeigten, dass nicht alle Kanäle gleich aussehen: Einige sind breit und offen, andere schmal und vermutlich geschlossen.
Entdeckung einer ringförmigen Kappe
An manchen Kanälen entdeckten die Forscher*innen eine zusätzliche Struktur: eine ringförmige „Kappe“, die auf der Zellinnenseite der einzelnen Kanäle saß und deren Öffnung umschloss. Bei dieser bislang unentdeckten Struktur handelt es sich um ein winziges, aber wichtiges Bauteil: Möglicherweise können die Synapsen ihre Verbindung damit wie ein Ventil regulieren – ein Mechanismus, der für die Steuerung elektrischer Signale im Herzen oder Darm entscheidend sein könnte.
Um herauszufinden, welches Protein diese „Kappe“ bildet, kombinierten die Forscher*innen ihre experimentellen Daten mit einer KI-Software, die Proteinstrukturen vorhersagen kann. Das Protein UNC-1 passte genau zur beobachteten Form der Kappe. Computersimulationen bestätigten, dass der UNC-1-Ring stabil auf dem Kanal sitzen kann und dass beide Proteine miteinander interagieren – als ob sie füreinander gemacht wären.
Bedeutung für menschliche Krankheiten
UNC-1 gehört zur Familie der Stomatin-ähnlichen Proteine, die auch im menschlichen Körper vorkommen und hier ringförmige Kappen ausbilden können. Stomatin findet sich etwa in roten Blutkörperchen, das verwandte Podocin in den Nieren. Mutationen dieser Proteine im Menschen stehen in Zusammenhang mit Erbkrankheiten wie etwa erblich bedingter Stomatocytose oder dem Steroid-resistenten nephrotischen Syndrom (SRNS). Auch Würmer mit defektem UNC-1 sind stark in ihrer Beweglichkeit eingeschränkt. „Die strukturelle Ähnlichkeit dieser Proteinfamilie über verschiedene Spezies hinweg ist bemerkenswert“, sagt einer der Erstautoren, Nils Rosenkranz, der sich für seine Doktorarbeit mit diesem Proteinkomplex beschäftigt. „Unsere Entdeckung legt nahe, dass die Regulation von Gap Junctions oder anderen Kanälen in der Zellmembran durch solche Kappen ein fundamentales Prinzip der Zellkommunikation sein könnte – vom Fadenwurm bis zum Menschen.“
Die Entdeckung wirft nun neue Fragen auf: Reguliert die „Kappe“ tatsächlich das Öffnen und Schließen der Kanäle? Wie beeinflusst sie den Fluss von Ionen? Die Forscher*innen vermuten, dass auch menschliche Gap Junctions von ähnlichen Kappen reguliert werden. Das könnte langfristig neue Therapieansätze für Krankheiten eröffnen, bei denen die Kommunikation zwischen Zellen gestört ist.
Goethe-Universität Frankfurt
Originalpublikation:
Nils Rosenkranz, Alexandra N. Birtasu, Konstantin Wieland, Lisa Rehm, Rachita Sharma, Atal Vats, Sina Manger, Aayush Srivastava, Abhishek Bhattacharya, Gerhard Hummer, Achilleas S. Frangakis, Alexander Gottschalk. In situ structure of a gap junction–stomatin complex. Science Advances (2025) https://www.doi.org/10.1126/sciadv.aea8596