Um krankheitsauslösende Proteine gezielt in menschliche Zellen einzuschleusen, nutzen bakterielle Krankheitserreger wie Salmonellen, Shigellen oder Yersinien das Typ-III-Sekretionssystem (T3SS) – eine Proteinstruktur, die als Injektionssystem genutzt wird. Dieses ist entscheidend dafür, dass die Bakterien eine Infektion auslösen können. Yersinia-Bakterien können so die menschliche Immunantwort unterdrücken. Doch die Aktivierung des T3SS hat ihren Preis: Sobald es aktiv ist, stellen die Bakterien ihr Wachstum ein, können sich also nicht weiter vermehren und ausbreiten. „Wie Yersinia enterocolitica diesen Konflikt zwischen Virulenz und Vermehrung löst, war bislang unklar“, sagt Dr. Andreas Diepold vom Institut für Angewandte Biowissenschaften des KIT.
Molekularer Schalter für Virulenz
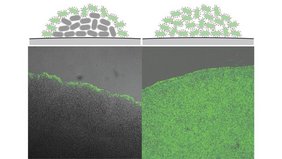
Ein Forschungsteam unter der Leitung von Diepold hat nun gezeigt: Y. enterocolitica besitzt eine Art Dichtesensor. Wenn sich viele Bakterien an einem Ort ansammeln, schaltet ein Regulationsmechanismus das T3SS ab. Nur die äußeren Zellen der Kolonie behalten das Sekretionssystem aktiv. „Damit können sich die Bakterien, die dem Immunsystem nicht ausgesetzt sind, weiter teilen“, erklärt Diepold. „Dieser Mechanismus ist hochspezifisch und reversibel. Sobald sich die Bakterien wieder ausbreiten, kann das System reaktiviert werden.“
Kern dieses Schalters ist das Protein VirF, das die Bildung des T3SS steuert. Bei hoher Zelldichte regulieren kleine RNA-Moleküle, die dann vermehrt auftreten, den Proteinkomplex herunter. Dadurch sinkt die Aktivität des gesamten Sekretionssystems deutlich.
Tarnmodus trickst das Immunsystem aus
Die Forschenden fanden zudem heraus, dass nicht nur das T3SS, sondern auch das Protein YadA, das für die Anheftung an Wirtszellen zuständig ist, abgeschaltet wird. Das macht das Bakterium gleichzeitig beweglicher und weniger auffällig für das Immunsystem. Dieser Tarnmodus könnte entscheidend dafür sein, dass das Bakterium neue Gewebe erreicht oder sich im Körper erneut ansiedelt.
„Unsere Ergebnisse zeigen, dass Yersinia nicht einfach passiv auf Umweltbedingungen reagiert, sondern aktiv zwischen einem virulenten und einem replizierenden Zustand wechselt“, sagt Diepold. „Das ermöglicht es dem Erreger, sich zunächst gegen die Immunabwehr zu behaupten und sich anschließend effizient zu vermehren.“ Das T3SS kann sich innerhalb von 30 bis 60 Minuten neu aufbauen.
Neue Perspektiven für die Infektionsforschung
Die Studie liefert wichtige Hinweise darauf, wie bakterielle Infektionen nicht nur beginnen, sondern auch fortschreiten. „Viele therapeutische Ansätze konzentrieren sich auf den Infektionsstart. Doch wir müssen auch verstehen, wie sich Erreger später im Körper verhalten“, so Diepold. Die spezifische Abschaltung des T3SS bei hoher Dichte sei dabei ein bislang unterschätzter, aber potenziell therapeutisch nutzbarer Mechanismus.
Langfristig könnten solche Erkenntnisse helfen, bakterielle Infektionen besser zu behandeln – etwa durch die gezielte Störung von Schaltmechanismen oder durch Einflussnahme auf die bakterielle Dichtewahrnehmung. „Je mehr wir über diese Systeme wissen, desto besser können wir sie aushebeln“, sagt Diepold.
Karlsruher Institut für Technologie
Originalpublikation:
Francesca Ermoli, Gabriele Malengo, Christoph Spahn, Corentin Brianceau, Timo Glatter and Andreas Diepold: Yersinia actively downregulates type III secretion and adhesion at higher cell densities, 2025, https://doi.org/10.1371/journal.ppat.1013423