Es kooperierten Forschende der Ruhr-Universität Bochum (RUB), der Max-Planck-Institute für Biochemie und Biophysik, des Zentrums für Synthetische Mikrobiologie (SYNMIKRO) und des Chemie Departments der Philipps Universität Marburg, der University of Illinois Urbana-Champaign, USA, und der Université Paris-Saclay, Frankreich.
Katalysator für Leben
Das Photosystem II (PS II) ist von fundamentaler Bedeutung für das Leben, da es in der Lage ist, die Spaltung von Wasser zu katalysieren. Der bei dieser Reaktion freigesetzte Sauerstoff lässt uns atmen. Außerdem wandelt PS II Lichtenergie derart um, dass atmosphärisches CO2 zur Synthese organischer Moleküle genutzt werden kann. PS II stellt damit den molekularen Beginn aller Nahrungsketten dar. Seine Struktur und Funktion wurden bereits im Detail erforscht, allerdings wusste man bisher wenig über die Molekülprozesse, die zu einem geordneten Zusammenbau des Komplexes führen.
Fließbandproduktion
PS II besteht aus mehr als 100 Einzelteilen, die in einem wohl orchestrierten Prozess zusammenfinden müssen, damit am Ende eine funktionierende Maschine entsteht. Eine entscheidende Rolle spielen dabei Helferproteine, die sogenannten Assemblierungsfaktoren, die für Teilschritte verantwortlich sind. „Man kann sich diese wie Roboter an einem Fließband, zum Beispiel zur Herstellung eines PKWs, vorstellen“, erklärt Prof. Dr. Marc Nowaczyk vom Lehrstuhl Biochemie der Pflanzen der RUB. „Jeder Roboter fügt ein Teil an oder setzt vorgefertigte Module zusammen, damit am Ende eine perfekte Maschine entstehen kann.“
Die Schwierigkeit zu schauen, wie dies vonstattengeht, bestand darin, ein Zwischenprodukt inklusive der dazugehörigen molekularen Helfer zu isolieren, denn solche Übergangszustände sind im Vergleich zum fertigen Produkt sehr instabil und nur in Kleinstmengen vorhanden. Nur durch Tricks, wie beispielsweise das Entfernen eines Teils der Fließbandfertigung, konnte erstmals ein Zwischenstadium mit den dazugehörigen Helferproteinen isoliert werden.
Kalte Einblicke: Kryo-Elektronenmikroskopie
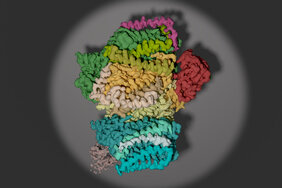
Dank des Verfahrens der Kryo-Elektronenmikroskopie können empfindliche Proteinstrukturen, zu denen PS II-Übergangszustände gehören, oder sogar kleinste Viruspartikel abgebildet werden. Die in Nature Plants veröffentlichten Daten zeigen die molekulare Struktur eines PS II-Übergangskomplexes mit gleich drei Helferproteinen. „Bei der Konstruktion des PS II-Strukturmodells stellte sich heraus, dass eines dieser Helferproteine bisher unbekannte Strukturveränderungen bewirkt, die wir mit einem neuartigen Schutzmechanismus in Verbindung bringen konnten“, erklärt Dr. Till Rudack vom Zentrum für Proteindiagnostik (PRODI) an der RUB. Bei diesem Schritt des Zusammenbauens ist PS II nämlich nur teilweise aktiv: Lichtinduzierte Prozesse können bereits ablaufen, die Wasserspaltung jedoch ist noch nicht aktiviert. Dies führt, so zeigte sich, zur Bildung von aggressiven Sauerstoffspezies, die den unfertigen Komplex schädigen können.
Die Bindung des Helferproteins und die damit verbundene Strukturänderung am PS II können die Bildung der schädlichen Moleküle jedoch vermindern und schützen so den Komplex in seiner verwundbaren Phase. Ein anderes Helferprotein wiederum bereitet die Aktivierung des Wasserspaltungsmechanismus vor. „Sobald es gelingt, weitere Zwischenstadien dieser Aktivierung aufzuklären, könnte dies der Schlüssel für ein tiefgreifendes Verständnis der molekularen, durch Licht getriebenen Wasserspaltung sein und die Entwicklung synthetischer Katalysatoren zur Energiewandlung von Sonnenlicht in organische Substanzen vorantreiben“, so das Autorenteam.
RUB
Originalpublikation:
Jure Zabret et al.: Structural insights into photosystem II assembly, Nature Plants, 2021, DOI: 10.1038/s41477-021-00895-0