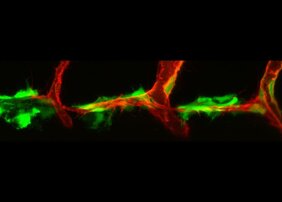
Entwickelt sich ein Embryo, setzen die verschiedenen Proteine und Enzyme eine Reihe von biochemischen Reaktionen in Gang. Eine Hauptrolle bei der Entwicklung von Lymphgefäßen spielt ein bestimmtes Protein: der Wachstumsfaktor VEGF-C. Damit er aktiv werden und viele aufeinanderfolgende Signale starten kann, muss sich das Protein zunächst in seiner biochemischen Form verändern. Wie und wo die dafür notwendigen Faktoren zusammenkommen und durch welche Zelltypen diese einzelnen Faktoren produziert werden, hatten Wissenschaftler aber bisher noch nicht herausfinden können.
Ein internationales Forscherteam hat jetzt bei Experimenten in Zebrafischen neue Erkenntnisse darüber gewonnen, auf welche Weise und an welchen Stellen die einzelnen Protagonisten des VEGF-C-Signalwegs im Embryo miteinander interagieren müssen, damit sich das lymphatische Gefäßsystem richtig ausbildet. Sie identifizierten spezielle Zellen des Bindegewebes, die an festgelegten Orten im Embryo sowohl das wichtige Protein VEGF-C selbst als auch zwei Enzym-spaltende Proteine herstellen, die ihrerseits das Protein VEGF-C aktivieren. Für eines dieser Proteine war zuvor noch nicht bekannt gewesen, dass es diese Rolle übernimmt.
„Die von uns identifizierten Zellen, die Fibroblasten, stellen scheinbar ,Hotspots' für das Auftreten des aktivierten Proteins dar“, sagt Studienleiter Dr. Andreas van Impel von der Westfälischen Wilhelms-Universität Münster (WWU). Die Ergebnisse liefern den Forschern neue grundlegende Erkenntnisse darüber, wie sich das Lymphgefäßsystem entwickelt und geben umgekehrt auch Aufschlüsse über Krankheiten des Systems. Funktioniert der Signalweg bei Menschen nicht richtig, können zum Beispiel genetisch bedingte Lymphödeme auftreten oder Krebszellen über die Lymphbahnen metastasieren. „Sollte sich herausstellen, dass eine vergleichbare Fibroblasten-Population auch im Menschen existiert, könnte dies auch für zukünftige Behandlungsstrategien verschiedener Erkrankungen von Relevanz sein“, betont Andreas van Impel. Die Studie ist in der Fachzeitschrift „Nature Communications“ erschienen.
Hintergrund und Methode:
Weltweit arbeiten rund 1.000 Forschergruppen mit Zebrafischen. An ihnen können sie gut untersuchen, wie sich ein Organismus entwickelt – unter anderem die Knochen, Blutgefäße und das Lymphsystem. Da sich die Fisch-Embryonen außerhalb des Mutterleibs entwickeln und in den ersten Tagen durchsichtig sind, können die Wissenschaftler die Veränderungen genau beobachten und daraus auch Verbindungen zum Menschen ziehen.
In ihrer aktuellen Studie sahen sich die Forscher das für das Wachstum wichtige Protein VEGF-C an. Damit es biologisch aktiv werden kann, muss es prozessiert werden – darunter versteht man die Abspaltung von Teilen des Proteins. Erst, wenn sich zwei sogenannte Prodomänen abgespalten haben, kann VEGF-C seinen Rezeptor binden und aktivieren. Die Enzyme, die das Protein spalten, werden Proteasen genannt. In ihrer Studie untersuchten die Wissenschaftler, welche Rolle die sekretierten Proteasen Adamts3 und Adamts14 bei der Aktivierung von VEGF-C haben.
Ihre Untersuchungen mit modernen lichtmikroskopischen Verfahren zeigten: Bei Embryonen, denen beide Proteasen aufgrund genetischer Mutationen fehlten, bildeten sich die Lymphgefäße nicht mehr aus, woraus die Forscher schlossen, dass die Prozessierung von VEGF-C nicht nur wie bislang angenommen von Adamts3, sondern auch von der verwandten Protease Adamts14 durchgeführt werden kann.
Das stellten die Wissenschaftler nicht nur bei den Proteinen in Zebrafischen fest, sondern auch bei Experimenten mit menschlichen Zellkulturlinien. „Unsere Beobachtung bedeutet, dass diese Fähigkeit des Adamts14-Proteins wohl über die Evolution konserviert wurde“, sagt Erstautorin Guangxia Wang. Sie führt ihre Promotion an der Graduiertenschule CiM-IMPRS der WWU durch, die zum Forschungsschwerpunkt „Zelldynamik und Bildgebung“ gehört.
In Zelltransplantations-Experimenten zeigten die Wissenschaftler, dass sowohl bestimmte neuronale Strukturen als auch Fibroblasten die zellulären Quellen für die beiden Proteasen und zudem direkt für das Protein VEGF-C darstellen. „Eine Aktivierung des Proteins an diesen Positionen im Embryo reichte aus, um eine normale Entwicklung der Lymphgefäße zu ermöglichen, was die Relevanz dieses Zelltyps für die Steuerung der Lymphangiogenese nochmals unterstreicht“, betont Andreas van Impel.
In weiterführenden Untersuchungen wollen die Forscher herausfinden, wie relevant die Aktivität von Adamts14 für die Entwicklung und Erhaltung des lymphatischen Gefäßsystems bei Säugetieren ist. „Da Mutationen der Adamts3-Protease bei Menschen zu Krankheitsbildern führen, liegt es nahe, dass Adamts14 ebenfalls ein Kandidat für humane Syndrome ist“, sagt Gruppenleiter Prof. Dr. Stefan Schulte-Merker. Darüber hinaus interessiert die Wissenschaftler, ob man eine vergleichbare Fibroblasten-Population auch in Mäusen und Menschen nachweisen kann, die ebenfalls alle oder zumindest eine Reihe von Proteinen synthetisiert, die wiederum bei der Prozessierung und damit bei der Kontrolle über die Aktivität des VEGF-C Signalwegs eine zentrale Rolle einnehmen.
WWU
Originalpublikation:
G. Wang et al. (2020): Specific fibroblast subpopulations and neuronal structures provide local sources of Vegfc-processing components during zebrafish lymphangiogenesis. Nature Communications; DOI: 10.1038/s41467-020-16552-7