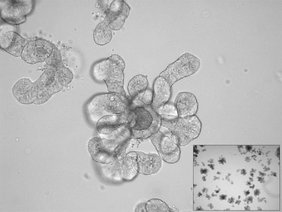
Um die Mechanismen der angeborenen Immunabwehr gegen Viren in Fledertieren aufzuklären, hat das Forschungsteam Organoide der Atemwege und des Darms aus Gewebe von Nilflughunden (Rousettus aegyptiacus), dem natürlichen Wirt des hochpathogenen Marburg-Virus und anderer zoonotischer Viren, hergestellt. „Aufgrund ihrer speziellen Lebensweise und der niedrigen Fortpflanzungsrate sind Fledertiere schwer zu untersuchen. Daher haben wir Organoide aus Schleimhautgewebe hergestellt, da diese sich in Kultur gut vermehren lassen und den ersten Kontakt mit Viren simulieren – Schleimhäute sind für viele Viren die Eintrittspforte in den Körper“, sagt Max Kellner, der seit April 2025 die Nachwuchsgruppe „Labor für Virus-Wirt Co-Evolution“ am HZI leitet.
Der Nilflughund gilt als natürlicher Wirt des hochpathogenen Marburg-Virus, das beim Menschen schweres hämorrhagisches Fieber auslösen kann und in 30 bis 90 Prozent der Fälle tödlich verläuft. Eine zugelassene Therapie oder Impfung gegen das Virus existiert bislang nicht. In enger Zusammenarbeit mit dem Team von Prof. Ali Mirazimi vom Karolinska-Institut in Stockholm konnten die Forschenden sowohl Flughund-Organoide als auch Organoide aus menschlichen Atemwegszellen im Hochsicherheitslabor der Schutzstufe 4 (S4) mit dem Marburg-Virus infizieren. Dabei zeigte sich, dass die Flughund-Organoide im Vergleich zu den menschlichen Modellen bereits vor einer Infektion eine deutlich erhöhte Grundaktivität der antiviralen Immunabwehr aufwiesen. „Unsere Experimente an Organoiden zeigten, dass die Epithelzellen von Nilflughunden im Vergleich zu denen des Menschen eine signifikant stärkere antivirale Grundabwehr und eine erhöhte Induktionsfähigkeit von antiviralen Reaktionen aufweisen, insbesondere durch das Interferon-System“, erklärt Max Kellner. „Interferone sind ein zentraler Bestandteil der angeborenen Immunabwehr und bekämpfen Virusinfektionen, indem sie Hunderte antiviraler Gene in Zellen aktivieren. Vermutlich ermöglicht dies Fledertieren, die Virusreplikation bereits früh in der Schleimhaut zu kontrollieren, während menschliche Zellen das Marburg-Virus zu Beginn der Infektion weniger effektiv erkennen, wodurch es sich ungehindert im Körper ausbreiten kann.“
Besonders Typ-III-Interferone spielen offenbar eine entscheidende Rolle in den Schleimhautzellen der Fledertiere: Nach der Infektion mit einer Vielzahl zoonotischer Viren reagierten Flughund-Organoide mit einer ausgesprochen starken Produktion dieser Interferone. Durch zusätzliche Stimulationsexperimente und genetische Modifikationen, wie etwa das gezielte Ausschalten des Interferon-Systems mittels CRISPR/Cas9, konnte die starke antivirale Aktivität der Interferone nachgewiesen werden. Zudem entdeckten die Forschenden einen selbstverstärkenden Genregulationsmechanismus der Typ-III-Interferone, der eine langanhaltende Schutzwirkung gegen Viren ermöglicht. „Die Ergebnisse dieser Studie deuten darauf hin, dass Fledertiere durch eine Kombination verschiedener angeborener Immunprozesse in der Lage sind, unkontrollierte Virusvermehrungen zu verhindern, wodurch die Entstehung viraler Krankheiten wahrscheinlich verhindert wird“, sagt Josef Penninger. „Für die Entwicklung antiviraler Therapien und die Bekämpfung zukünftiger Pandemien ist es essenziell, die Resilienzmechanismen dieser Tiere gegenüber hochpathogenen Viren und die evolutionäre Anpassung ihres Immunsystems zu verstehen.“
Neben den neuartigen Erkenntnissen zu den antiviralen Mechanismen der Fledermaus-Schleimhäute bieten die entwickelten Organoide eine innovative Plattform, um die komplexe Biologie von Fledermäusen auf genetischer und molekularer Ebene zu untersuchen. Das Forschungsteam plant nun, die Organoid-Modelle in ihrer Komplexität weiterzuentwickeln und sie der wissenschaftlichen Gemeinschaft zur Verfügung zu stellen. „Uns ist es ein besonderes Anliegen, unsere Erkenntnisse und die neu entwickelte Plattform im Sinne der Demokratisierung allen Forschenden zugänglich zu machen“, sagt Penninger. „Nur gemeinsam können wir die komplexen Mechanismen verstehen, die die Evolution zum Beispiel bei den Fledertieren hervorgebracht hat, und davon ausgehend neue Ansätze für die Abwehr und Behandlung viraler Erkrankungen entwickeln.“
HZI
Originalpublikation:
Kellner, M.J., Monteil, V.M., Zelger, P. et al. Bat organoids reveal antiviral responses at epithelial surfaces. Nat Immunol (2025). doi.org/10.1038/s41590-025-02155-1