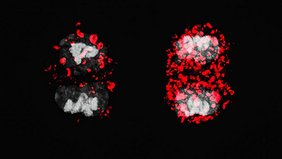
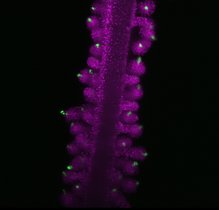
Wenn sich die T-Zellen unseres Immunsystems teilen, geschieht das in der Regel nicht symmetrisch. Die beiden Tochterzellen erben unterschiedliche Zellkomponenten, die über ihr weiteres Schicksal entscheiden: Eine Zelle wird zu einem kurzlebigen Kämpfer, der T-Effektorzelle; die andere entwickelt sich zu einer langlebigen T-Gedächtniszelle.
Eine Team um Professorin Mariana Borsa von der University of Oxford und Professorin Katja Simon, die Leiterin der Arbeitsgruppe „Zellbiologie der Immunität“ am Max Delbrück Center, hat jetzt gezeigt, dass die Autophagie – eine Art zellulärer Hausputz, bei dem die Zelle nicht mehr benötigte Bestandteile abbaut und recycelt – in dem Entscheidungsprozess dieser asymmetrischen Zellteilung (Asymmetric Cell Division, kurz ACD) eine entscheidende Rolle spielt.
„Unsere Studie beweist zum ersten Mal kausal, dass T-Zellen die ACD ohne Autophagie nicht normal durchlaufen“, sagt Borsa, Erstautorin der Studie und inzwischen als Professorin der Universität Basel ihre eigene Arbeitsgruppe leitet. „Wir haben herausgefunden, dass bei der Teilung einer T-Stammzelle die Tochterzellen unterschiedliche Mitochondrien erben – was ihr weiteres Schicksal beeinflusst. Wenn wir diesen Prozess verstehen, können wir darüber nachdenken, was sich tun lässt, um die Funktion der T-Gedächtniszellen im Alter zu erhalten.“
Gespaltene Persönlichkeit
Um die ACD detailliert zu untersuchen, nutzten die Forschenden ein neuartiges Mausmodell, MitoSnap genannt. In ihm lassen sich die Mitochondrien so markieren, dass man sie in Mutter- und Tochterzellen voneinander unterscheiden und getrennt verfolgen kann. T-Zellen enthalten viele dieser Zellorganellen, die vor allem für die Energieproduktion der Zellen erforderlich sind.
Das Team um Borsa und Simon untersuchte, wie alte, beschädigte Mitochondrien zwischen den Tochterzellen verteilt werden. Die Wissenschaftler*innen fanden heraus, dass in gesunden Zellen die Autophagie benötigt wird, damit eine Tochterzelle keine alten Mitochondrien erhält. Das wiederum führt dazu, dass sich diese Zelle zu einer langlebigen Gedächtnisvorläuferzelle entwickelt – einer Immunzelle, die sich an einen Erreger erinnert und sich schnell zu teilen beginnt, wenn sie erneut auf ihn stößt. Die andere Tochterzelle, die die alten Mitochondrien übernommen hat, entwickelt sich hingegen zu einer kurzlebigen Effektorzelle. Diese Zellen teilen sich schnell und wehren unmittelbare Bedrohungen ab. Ist die akute Gefahr beseitigt, sterben sie ab.
Wird die Autophagie gestört, bricht die sorgfältige Sortierung zusammen. Beide Tochterzellen erben dann beschädigte Mitochondrien und sind folglich dazu bestimmt, kurzlebige Zellen zu werden. „Es war überraschend zu sehen, dass die Autophagie eine Rolle spielt, die über die reine Zellpflege hinausgeht“, sagt Borsa. „Unsere Ergebnisse deuten darauf hin, dass die asymmetrische Vererbung von Mitochondrien ein potenzielles therapeutisches Ziel für die Verjüngung von T-Gedächtniszellen darstellt.“
Die Impfreaktion verstärken
Indem man die Autophagie vor oder während der Teilung der T-Stammzellen stimuliert, könnte es möglich sein, mehr Gedächtniszellen zu erhalten und auf diese Weise den langfristigen Schutz nach Infektionen oder durch Impfstoffe zu verbessern – so die Hoffnung der Forschenden.
In einem weiteren Schritt analysierte das Team die Tochterzellen mithilfe der Einzelzell-Transkriptomik, -Proteomik und -Metabolomik. Dabei stellten die Wissenschaftler*innen fest, dass Effektorzellen mit beschädigten Mitochondrien stark von einem bestimmten Stoffwechselweg, dem C1-Stoffwechsel, abhängig sind. Ihn gezielt zu manipulieren, könnte eine weitere Möglichkeit sein, das Immunsystem subtil zu beeinflussen und T-Stammzellen dazu zu bewegen, sich eher zu Gedächtnis- als zu Effektorzellen zu entwickeln, spekuliert Borsa.
„Langfristig könnte diese Forschung zu Strategien beitragen, um das alternde Immunsystem zu verjüngen, wodurch Impfstoffe wirksamer werden und der Schutz vor Infektionen gestärkt wird“, fügt Simon hinzu. Die Forschenden planen nun, ihre Ergebnisse in Experimenten mit menschlichen T-Zellen weiter zu validieren.
Max Delbrück Center
Originalpublikation:
Borsa, M., Lechuga-Vieco, A.V., Kayvanjoo, A.H. et al. Autophagy-regulated mitochondrial inheritance controls early CD8+ T cell fate commitment. Nat Cell Biol (2025). doi.org/10.1038/s41556-025-01835-2