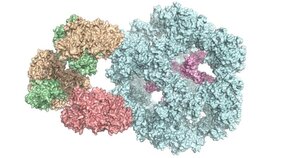
Enzyme sind die Biokatalysatoren der Zelle. Sie sorgen dafür, dass chemische Reaktionen im Körper schneller ablaufen oder überhaupt erst stattfinden können. Deswegen sind sie enorm wichtig für den Stoffwechsel. In vielen Fällen setzen sich einzelne Enzyme zu einem Verbund mit vielen Untereinheiten zusammen, wie beim Pyruvat-Dehydrogenase-Komplex. Er kommt in allen menschlichen, tierischen und pflanzlichen Zellen sowie in Pilzen und sogar einigen Bakterien vor. "Er ist essenziell für die Energiegewinnung in den Zellen", erklärt Jun.-Prof. Dr. Panagiotis Kastritis vom Zentrum für Innovationskompetenz HALOmem an der MLU.
"Bisher wurde der Enzymkomplex immer nur in seine Einzelteile zerlegt und dann untersucht. Den gesamten, funktionalen Komplex zu erforschen ist sehr kompliziert", so Kastritis. Sein Team kombinierte verschiedene biochemische und biophysikalische Untersuchungsmethoden, um das Problem zu lösen. Neben Massenspektrometrie und chemischen Analysen sei eine spezielle Form der Elektronenmikroskopie entscheidend, um eine so komplexe Struktur zu erforschen, so der Strukturbiologe: die Kryo-Elektronenmikroskopie. Sie diene dazu, komplexe, organische Strukturen mit höchster Auflösung und in ihrem natürlichen Zustand zu betrachten. "Besonders wichtig ist aber, diese ganzen Daten anschließend in Computermodellen zusammenzubringen", so Kastritis. Für die aktuelle Arbeit nutzt das Team Zellextrakte eines Pilzes, der auch bei hohen Temperaturen überleben kann, was die Analysen vereinfacht.
Die Wissenschaftler erhielten so zum ersten Mal einen Einblick in das Zusammenspiel der verschiedenen Untereinheiten des Enzymkomplexes und stellten dabei auch fest, dass er anders funktioniert als bisher angenommen. "Bisher ging man davon aus, dass alle Untereinheiten direkt an der Reaktion beteiligt sind", sagt Kastritis. "Wir haben jetzt aber gesehen, dass manche von ihnen offenbar eine Art Kammer bilden, die die Reaktion abschirmt." Durch die sehr große Ähnlichkeit der Komplexe in verschiedenen Organismen helfen die Ergebnisse auch, den menschlichen Pyruvat-Dehydrogenase-Komplex zu verstehen.
Die neue Methode könnte dabei helfen, zahlreiche Krankheiten besser zu verstehen. Manche Viren reduzieren zum Beispiel die Anzahl der Enzymverbünde in den Zellen. Auch bei Alzheimer sei der Effekt beobachtet worden. Teilweise werde aber auch die Funktion der Enzyme gestört und die lebenswichtigen Reaktionen laufen entweder zu langsam oder zu schnell ab. "Wenn wir die natürliche Struktur besser verstehen, können wir auch winzige Änderungen sehen und verstehen, warum die Reaktion nicht mehr richtig abläuft", so Kastritis. Dieses Wissen könne theoretisch auch die Grundlage für neue Behandlungsoptionen darstellen.
MLU
Originalpublikation:
Kyrilis F. L. et al. Integrative structure of a 10-megadalton eukaryotic pyruvate dehydrogenase complex from native cell extracts. Cell Reports (2021).