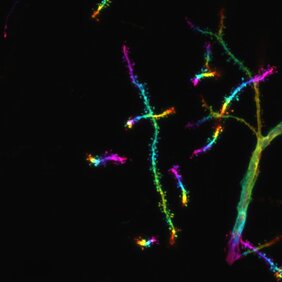
Kürzlich wurde festgestellt, dass der HUSH-Komplex (Englisch „Human Silencing Hub“) von zentraler Bedeutung für die Stilllegung repetitiver genetischer Elemente ist, einschließlich Transposons in Säugetieren. Der HUSH-Komplex enthält MPP8, ein Protein, das die Histonmodifikation H3K9me3 bindet. Außerdem ist bekannt, dass HUSH andere Proteine rekrutiert, darunter das Zinkfingerprotein MORC2. Beim Menschen werden Mutationen, die MORC2 betreffen, mit axonaler Neuropathie, einer Art von Nervenschädigung, und neurologischen Entwicklungsstörungen in Verbindung gebracht. Über die physiologischen Funktionen von MPP8 und MORC2 oder ihre möglichen Auswirkungen auf die Gesundheit des Gehirns ist jedoch wenig bekannt. ForscherInnen unter der Leitung von Astrid Hagelkruys, Senior Research Associate in der Penninger-Gruppe am IMBA, untersuchten daher die Ziele und Funktionen dieser beiden Proteine In-vivo in Labormausmodellen und in Gehirnorganoiden aus menschlichen Stammzellen.
Veränderte Gehirnentwicklung, verändertes Verhalten
Das Team verwendete einen umfassenden In-vivo-Ansatz mit Experimenten zu Verhalten, Motorik, Entwicklung, Genetik und Transkriptomik. Sie fanden heraus, dass MPP8 und MORC2A (das Maus-Protein, das mit dem menschlichen MORC2 verwandt ist) im Gehirn stark vertreten sind, wo sie ausschließlich in Neuronen zu finden sind. „Wir konnten zeigen, dass MPP8 und MORC2A eine Rolle bei der normalen Entwicklung des Gehirns, der Spezifizierung der neuronalen Identität und der Konnektivität von Neuronen sowie beim Verhalten von Mäusen spielen“, sagt Astrid Hagelkruys, die Projektleiterin und eine der korrespondierenden AutorInnen der Studie.
Wenn MPP8 oder MORC2A im Nervensystem der Mausmodelle entfernt wurden, beobachteten die ForscherInnen außerdem eine Vergrößerung des Gehirns und eine veränderte Gehirnarchitektur, ohne wesentliche Veränderung in der Expression von Transposons. Das Fehlen von MPP8 oder MORC2A beeinträchtigte die motorischen Funktionen und das Verhalten der Mäuse und zeigt, dass MPP8 und MORC2A über die Regulierung von Transposons hinaus wirken.
Molekularer Mechanismus, der an Gen-Stilllegung erinnert
Bisher war bekannt, dass der HUSH-Komplex an der Regulation von Transposons beteiligt ist. „Wir haben gezeigt, dass MPP8 und MORC2A die Protocadherin-Gencluster in einer H3K9me3-abhängigen Weise unterdrücken. Auf der Protein-Ebene bilden diese Protocadherin-Gencluster neuronale Oberflächenproteine, die Kontakte zu anderen Neuronen erlauben. Obwohl die Protocadherin-Gencluster keine Transposons sind, sind sie im Genom direkt hintereinander angeordnet“, erklärt Hagelkruys. In den Mausmodellen waren MPP8 und MORC2A dafür verantwortlich, spezifisch die Protocadherin-Gencluster auf Maus-Chromosom 18 zu regulieren. Das Fehlen von MPP8 und MORC2A führte dazu, dass mehr Protocadherine aktiv waren und sich mehr Synapsen in den Neuronen bildeten, was mit einer Beeinträchtigung der neuronalen Individualität einhergehen könnte. Mit anderen Worten, die Fähigkeit der Neuronen, „selbst“ von „nicht-selbst“ zu unterscheiden, wurde dadurch beeinträchtigt. Durch die Expression verschiedener Kombinationen von unterschiedlichen Protocadherinen entsteht eine Art „Barcode“, der die Bildung synaptischer Verbindungen mit anderen Neuronen steuert. Indem MPP8 und MORC2A auf Protocadherin-Cluster abzielen, können sie sicherstellen, dass der richtige neuronale „Barcode“ entsteht und Neuronen ihre Synapsen nur mit den richtigen Gegenspielern bilden.
Darüber hinaus untersuchte das Team, wie sich ein Mangel an MPP8 und MORC2 in menschlichen Gehirnorganoiden auswirkt. Bei der Verwendung dieses aus Stammzellen abgeleiteten Modells des menschlichen Gehirns beobachteten die WissenschaftlerInnen übereinstimmende Ergebnisse: Das Fehlen von MPP8 oder MORC2 führte zu einer erhöhten Anzahl von verschiedenen Protocadherinen, die pro Zelle exprimiert wurden. Dies deutet darauf hin, dass das Fehlen der beiden Proteine die neuronale Identität auch in menschlichen Gehirnorganoiden stört.
Die Epigenetik von Gehirn-Erkrankungen und neurologischen Störungen
Mit der aktuellen Arbeit fanden die ForscherInnen eine zentrale Rolle des HUSH-Komplexes bei der epigenetischen Regulierung der Protocadherin-Expression im Nervensystem. Diese Ergebnisse bringen die Stilllegung „repetitiver“ genetischer Elemente mit der Physiologie und dem Verhalten des Mäusegehirns in Verbindung. Die Ergebnisse des Teams in Gehirnorganoiden zeigen auch, dass ähnliche Effekte beim Menschen auftreten können. „Das Interessante an diesen Erkenntnissen über die essenzielle Funktion des HUSH-Komplexes im Gehirn liegt in der Bedeutung der Protocadherine für neuronale Identität und die Evolution des Gehirns. Wie dies jedoch reguliert wird, blieb weitgehend unbekannt. Die Dysregulation von Protocadherinen wurde mit verschiedenen neurologischen und neuroentwicklungsbedingten Krankheiten, aber auch mit zahlreichen psychischen Störungen beim Menschen in Verbindung gebracht. Unsere Ergebnisse könnten uns daher helfen, die epigenetischen Regulationsmechanismen bei diesen Krankheiten besser zu verstehen, und einen neuen Weg zur Untersuchung der Gehirnevolution eröffnen“, schließt Josef Penninger, Gruppenleiter am IMBA.
Josef Penninger war der Gründungsdirektor des IMBA und ist derzeit Direktor des Life Sciences Institute an der University of British Columbia (UBC) in Vancouver, Kanada.
(IMBA - Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften GmbH)
Originalveröffentlichung:
Hagelkruys, A., et al., "The HUSH complex controls brain architecture and protocadherin fidelity". Science Advances, 2022. DOI: https://doi.org/10.1126/sciadv.abo7247