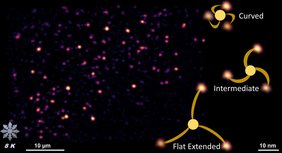
Traditionell wird die Struktur von Proteinen mit Methoden wie der Röntgenbeugung oder der hochauflösenden Elektronenmikroskopie untersucht. Erstere Methode bietet eine ausgezeichnete Auflösung, erfordert jedoch kristallisierte Proteine. Letztere Methode erlaubt zwar Untersuchungen einzelner Proteine, weist jedoch einen geringen Kontrast auf und ist wenig geeignet, wenn das Protein von anderen Biomolekülen umgeben ist. Die optische Mikroskopie von Proben, die in ihrem nahezu natürlichen Zustand konserviert sind, stellt eine vielversprechende Alternative dar, da sie eine Genauigkeit im Ångström-Bereich erreichen kann. Diese untersucht ein Team der Abteilung ›Nanooptik‹ von MPL-Direktor Prof. Vahid Sandoghdar. Der methodische Durchbruch ist insbesondere für die Untersuchung von Membranproteinen von großer Bedeutung. Sie sitzen in der Zellmembran und fungieren als Sensoren und Kommunikationsschnittstelle. Eines dieser Proteine, PIEZO1, spielt eine zentrale Rolle bei der Wahrnehmung von Berührung und Druckreizen bei Säugetieren. Frühere Studien mit kryo-elektronenmikroskopischen (cryo-EM) Verfahren zeigten, dass PIEZO1 eine kuppelartige Struktur mit drei ‚Flügeln‘ bildet, die die Zellmembran wölbt. In der neuen Arbeit markierte das Forschungsteam das Protein mit fluoreszierenden Markern und konnte es in nahezu nativer Umgebung innerhalb der Zellmembran bei 8 K abbilden. Das Experiment ermöglichte dem Team mehrere unterschiedliche Konfigurationen der PIEZO1-Flügel sichtbar zu machen – und lieferte damit neue Erkenntnisse darüber, wie sich das Protein bei mechanischer Reizung verformt und ausdehnt.
„Die entscheidende Innovation war das schnelle Einfrieren in einem flüssigen Kryogen – ein Prozess, der so schnell abläuft, dass die Wassermoleküle nicht kristallisieren und die Proteinstruktur somit intakt bleibt“, erklärte der Erstautor Dr. Hisham Mazal. Anschließend wurde die schockgefrorene Probe in einen Kryostaten eingesetzt, in dem sich das Mikroskop befindet – dabei musste jederzeit gewährleistet sein, dass die Probe vollständig kalt bleibt und keinem Luftkontakt ausgesetzt wird. „Um dies zu ermöglichen, entwickelten und konstruierten wir eine komplexe Apparatur, darunter ein kryogenes optisches Mikroskop und ein spezielles Vakuum-Shuttle“, so Prof. Vahid Sandoghdar. Dieser Ansatz bewahrt nicht nur die native Struktur des Proteins und seiner Umgebung, sondern verlängert auch die Lebensdauer der Fluoreszenzmarker erheblich. Dadurch können deutlich mehr Photonen von jedem fluoreszierenden Molekül gesammelt werden. „So gelingt es uns, die Position jedes Moleküls mit einer bemerkenswerten Genauigkeit von nur wenigen Ångström zu bestimmen – das entspricht dem Durchmesser einzelner Atome“, erläuterte Prof. Sandoghdar.
Für die Zukunft plant das Team, diese Technik mit hochauflösender Kryo-EM zu kombinieren. „Diese Entwicklung eröffnet ein neues Forschungsfeld in der Strukturbiologie und rückt uns einen bedeutenden Schritt näher an das quantitative Verständnis der molekularen Funktionsweise des Lebens“, betonte Dr. Mazal.
Max-Planck-Institut für die Physik des Lichts
Originalpublikation:
H. Mazal, F. Wieser, D. Bollschweiler, A. Schambony, and V. Sandoghdar. Cryo–light microscopy with angstrom precision deciphers structural conformations of PIEZO1 in its native state. Science Advances (2025). DOI: https://doi.org/10.1126/sciadv.adw4402