In jeder Muskelfaser schlummern spezialisierte Stammzellen. Diese Muskelstammzellen, auch als Satellitenzellen bekannt, sorgen dafür, dass im Falle einer Verletzung beschädigte Muskelfasern erneuert werden. Um ihr Leben lang funktionsfähig zu bleiben, müssen sie sich sowohl selbst erneuern als auch in einem Ruhezustand verbleiben können, bis sie benötigt werden. Sobald sie aktiviert werden, besteht ihre Aufgabe darin, beschädigtes Gewebe schnell zu reparieren, um die Integrität des Muskels wiederherzustellen.
Wissenschaftler der Abteilung „Entwicklung und Umbau des Herzens“ unter der Leitung von Direktor Thomas Braun am Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim haben nun herausgefunden, dass TAF4A, ein Bestandteil des allgemeinen Transkriptionsapparats, eine entscheidende Rolle bei der Aufrechterhaltung der Integrität und Funktion von Muskelstammzellen spielt.
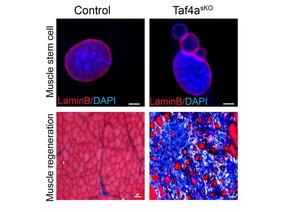
„TAF4A ist ein Transkriptionsfaktor, der die Expression eines wichtigen Bestandteils des sogenannten NSL-Komplexes steuert. Dieser Komplex ist für die Acetylierung von Lamin A/C und die Stabilität der Kernlamina verantwortlich – einem Stütznetzwerk im Zellkern”, erklärt Angelina Georgieva, Erstautorin der Studie. Die Max-Planck-Forscher fanden heraus, dass in genetisch veränderten Mäusen, bei denen TAF4A in Muskelstammzellen ausgeschaltet war, die Zellen vorzeitig aktiviert wurden und ihr Reservoir schnell erschöpft war. „Bei Tieren ohne TAF4A ist die Ruhe- und Selbsterhaltungsphase der Muskelstammzellen gestört. Dies führt zu einer Erschöpfung des Muskelstammzellpools“, sagt Georgieva. Das Fehlen von TAF4A führte zu DNA-Schäden, missgebildeten Zellkernen und einer stark beeinträchtigten Muskelregeneration nach Verletzungen. Anstelle neuer Muskelfasern bildete sich Narbengewebe.
Mutationen im TAF4A-Gen verursachen bekanntermaßen auch TAF4-bedingte neurologische Entwicklungsstörungen beim Menschen. Die Forscher vermuten nun, dass bei diesen Patienten auch die Skelettmuskulatur betroffen sein könnte, obwohl die Symptome aufgrund der ausgeprägten neurologischen Komplikationen möglicherweise übersehen wurden. Darüber hinaus ist bekannt, dass Mutationen in Lamina-Genen eine Gruppe von Erkrankungen verursachen, die als Laminopathien bezeichnet werden. Dies betrifft Muskeln und andere Organe und steht mit vorzeitiger Alterung und Instabilität des Genoms in Verbindung. Die Max-Planck-Forscher zeigen nun, dass das Fehlen von TAF4A die posttranslationalen Anpassungen von Lamin A/C beeinflusst. Die Folge davon ist ein instabiler Zellkern.
„Letztendlich verhindert TAF4A die Kaskade molekularer Ereignisse, die zu irreversiblen Schäden in Muskelstammzellen führen“, erklärt Prof. Thomas Braun. „Wenn dieser Wächter fehlt, verlieren die Zellen ihre Funktion und die Muskeln ihre Regenerationsfähigkeit.“
Co-Autorin Xuejun Yuan ergänzt: „Die Studie bietet neue Einblicke in die molekularen Mechanismen, welche die für die Muskelregeneration erforderlichen Muskelstammzellen schützen.“ Die Bad Nauheimer Wissenschaftler hoffen, einen vielversprechenden Ausgangspunkt für neue therapeutischer Ansätze zur Behandlung von TAF4-bedingten neurologische Entwicklungsstörungen und altersbedingten Muskeldegeneration gefunden zu haben.
Max-Planck-Institut für Herz- und Lungenforschung
Originalpublikation:
Georgieva, A.M., Sreenivasan, K., Ding, D. et al. Regulation of NSL by TAF4A is critical for genome stability and quiescence of muscle stem cells. Nat Commun16, 8726 (2025). doi.org/10.1038/s41467-025-64402-1