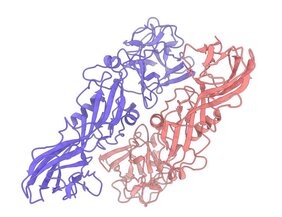
Das untersuchte Gift-Protein trägt die Bezeichnung Tpp49Aa1 und stammt aus dem Bodenbakterium Lysinibacillus sphaericus. Es ist bekannt, dass es in Kombination mit einem anderen Protein namens Cry48 als Gift gegen die südliche Hausmücke Culex quinquefasciatus, die verschiedenen Krankheitserreger wie das Zikavirus und das West-Nil-Virus verbreitet. „Tatsächlich wirkt das Insektizid aber auf mehr Moskitoarten als gedacht, wie sich in unserer Untersuchung gezeigt hat“, berichtet Biochemiker Berry. Im Rahmen der Untersuchung testete Kolleg:innen des Teams das Toxin in vivo an verschiedenen Moskitoarten. Demnach lässt es sich auch gegen die Malariamücke Anopheles stephensi, die asiatische Tigermücke Aedes albopictus und die in Kalifornien beheimatete Mücke Culex tarsalis einsetzen.
„Die Informationen über die detaillierte Struktur des Toxins geben Hinweise darauf, wie es sich an den Organismus anlagern könnte, um seine Wirkung zu entfalten“, erläutert Oberthür. „Dies eröffnet die Chance, es so zu verändern, dass es noch spezifischer nur an eine Bindungsstelle einer bestimmten Moskito-Art passt.“ Das ist nicht nur für die Bekämpfung von Krankheitsüberträgern interessant, sondern auch in der Landwirtschaft, wo verschiedene Bakterientoxine schon seit Langem eingesetzt werden und einen großen Markt darstellen. In beiden Fällen sollen die Gifte dabei möglichst gezielt schädliche Insekten töten und alle anderen Organismen verschonen.
Um die Struktur des Proteins zu bestimmen, nutzten die Forscherinnen und Forscher winzige Proteinkristalle, die direkt vom Bakterium stammen. Sie sind typischerweise kleiner als einen halben tausendstel Millimeter. Um derart kleine Kristalle zu durchleuchten, ist extrem helles und gebündeltes Röntgenlicht nötig, wie es nur ein Röntgenlaser erzeugen kann. Das Röntgenlicht wird von Atomen im Kristall gestreut, und aus dem entstehenden Streubild lässt sich ihre räumliche Struktur berechnen, also die der Proteine.
Um ein vollständiges Bild zu erhalten, muss der Kristall von allen Seiten durchleuchtet werden. Beim Beschuss mit dem energiereichen Röntgenlaser wird er allerdings nach einer Aufnahme sofort zerstört. Die Forscherinnen und Forscher machen daher in solchen Fällen Aufnahmen von zahlreichen Kristallen und kombinieren diese Bilder (die sogenannte „Serial Femtosecond Crystallography“, kurz „SFX“ genannt). Je mehr verschiedene Aufnahmen möglich sind, desto besser wird die Detailgenauigkeit der Untersuchung. Dank der extrem hohen Blitzrate des European XFEL konnte das Team an der SPB/SFX Experimentierstation des Röntgenlasers rund zwei Millionen Aufnahmen winziger Kristalle kombinieren. Die Auswertung liefert die räumliche Struktur des Proteins mit einer Auflösung von 0,162 Nanometern (millionstel Millimetern), das entspricht dem Durchmesser eines Kohlenstoffatoms.
„Natürliche Insektizide können eine Schlüsselrolle dabei spielen, Krankheiten zu bekämpfen oder vielleicht auch Ernten nachhaltig vor Schädlingen zu schützen“, erklärt Oberthür. „Mit dem extrem hellen und intensiven Röntgenlaserpulsen konnten wir die unveränderten Insektizid-Kristalle untersuchen und ihre Struktur beschreiben. Dies könnte in Zukunft dazu beitragen, die Entwicklung von Resistenzen gegen Insektizide bei Insekten aufzuklären.“
Center for Free-Electron Laser Science, DESY
Originalpublikation:
Lainey J. Williamson, Marina Galchenkova , Hannah L. Best , Richard J. Bean, et al.: Structure of the Lysinibacillus sphaericus Tpp49Aa1 pesticidal protein elucidated from natural crystals using MHz-SFX; PNAS, 2023; DOI:10.1073/pnas.2203241120, https://doi.org/10.1073/pnas.220324112