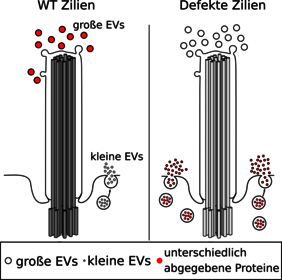
Weltweit leidet einer unter tausend Menschen unter Ziliendefekten. Zu den Symptomen gehören Augenleiden, Gehörverlust, Adipositas, Nierenleiden, geistige Defizite und viele andere, teils schwerwiegende Erkrankungen, die auch gleichzeitig auftreten können. Bisher stehen keine Therapien zur Verfügung und die Behandlung beschränkt sich auf die Kontrolle der Symptome wie etwa eine Nierentransplantation. „Wir wissen erst seit etwa zwanzig Jahren, welche wichtige Rolle die Primärzilien spielen. Ihre Fehlfunktion führt zu einer Reihe von Erbkrankheiten, die als Ziliopathien bezeichnet werden“, erklärt Prof. Dr. Helen May-Simera von der Johannes Gutenberg-Universität Mainz (JGU). Die Biochemikerin forscht über das Bardet-Biedl-Syndrom (BBS), die schwerwiegendste Ziliopathie. Neue Ergebnisse ihrer Arbeitsgruppe zeigen, wie Signale von fehlerhaften Zilien zu der Erkrankung beitragen.
Fehlerhafte Primärzilien sind für unterschiedliche Krankheitszeichen verantwortlich
Primärzilien sind dünne, wimpernähnliche Fortsätze an der Oberfläche von Zellen. Fast jede Zelle im Körper besitzt eine solche Zilie, allerdings führen Defekte dieser Ausstülpungen nicht in allen Geweben zu schwerwiegenden Problemen. Weil sie aber praktisch auf allen Zelltypen von Wirbeltieren zu finden sind, kann eine Erkrankung viele verschiedene Organe und Gewebe betreffen und somit auch ganz unterschiedliche Krankheitszeichen hervorrufen. Früher konnten die Syndrome häufig nicht zugeordnet werden, aber dank genetischer Untersuchungen werden Erbkrankheiten infolge von Ziliopathien heute besser erkannt.
Das Bardet-Biedl-Syndrom kommt weltweit unter 25.000 Menschen ein Mal vor, ist also relativ selten. Es gilt aber als archetypische Ziliopathie, weil die Ausprägungen besonders vielfältig sind. „Die Patientinnen und Patienten weisen fast sämtliche Symptome auf: Sie können erblinden, besitzen mehrere Finger oder Zehen, leiden unter Übergewicht oder einer Nierenerkrankung und häufig an weiteren sekundären Problemen“, beschreibt May-Simera das Krankheitsbild. Wegen der Vielfältigkeit gilt BBS als wertvolles Modell für die Grundlagenforschung und für die Entwicklung von Therapeutika, weil Ergebnisse auf andere Ziliopathien übertragen werden könnten. „Wenn wir dieses Modellsystem verstehen, können wir auch andere Ziliopathien verstehen“, so die Wissenschaftlerin.
Zilien steuern die Kommunikation zwischen Zellen
„Primärzilien galten lange als unnötig. Heute wissen wir, dass diese kleine Struktur für viele Prozesse in der Zelle wichtig ist. Zilien regulieren nämlich die Kommunikation zwischen Zellen“, sagt Helen May-Simera. Ist diese Struktur defekt, entstehen Krankheiten. Die Zilie dient der Zelle als Antenne, die eingehende Signale empfangen kann. Die Arbeitsgruppe von May-Simera hat nun erstmals an Säugetierzellen gezeigt, dass Zilien nicht nur für den Empfang von Signalen zuständig sind, sondern auch die Aussendung von biologisch wirksamen Signalen an andere Zellen steuern. „Dabei steuern die Zilien die Abgabe von kleinen Vesikeln, im Fachjargon extrazelluläre Vesikel genannt. Diese Signale sind bioaktiv, das heißt sie werden von den Empfängerzellen aufgenommen und können dort zelluläre Prozesse regulieren, auch wenn wir noch nicht wissen, wie das genau funktioniert.“ May-Simera vergleicht die Vorgänge mit dem Versand von kleinen Postpaketen von einer Zelle zu einer anderen. Wenn die Pakete ankommen, werden sie ausgepackt und ihr Inhalt löst in der Zelle weitere Prozesse aus. Dass Zilien auch Signale abgeben, war bisher nur von Algen und anderen niederen Lebensformen bekannt.
Der Nachweis gelang dem Team um May-Simera an Nierenzellen von Mäusen. So zeigten die Forschenden, dass die geschädigten Zellen fast viermal so viele kleine Vesikel freisetzen wie gesunde Zellen. Kommen die Vesikel bei der Empfängerzelle an, setzen sie dort Mechanismen in Gang, die zu einer Verstärkung der Defekte führen. „Wenn die Zilien gestört sind, dann sendet die Zelle falsche Signale aus und es kommt zu falschen Reaktionen beim Empfänger“, so May-Simera. Nierenzellen sind für die Untersuchung besonders geeignet, weil Nierenerkrankungen bei BBS zu den häufigsten Symptomen gehören und am stärksten zur Sterblichkeit beitragen.
Zusammenarbeit mit anderen Gruppen der Biologie erfolgreich
Die wichtige Rolle der extrazellulären Vesikel konnte in Zusammenarbeit mit der Gruppe von Prof. Dr. Eva-Maria Krämer-Albers am Institut für Entwicklungs- und Neurobiologie der JGU gezeigt werden. Extrazelluläre Vesikel sind wie kleine Postpakete, die mit Proteinen, RNA und manchmal auch DNA gefüllt sind. „Offenbar schicken die Zilien bei einer Fehlfunktion vermehrt kleinere Vesikel mit unterschiedlichem Inhalt auf die Reise“, sagt Eva-Maria Krämer-Albers.
„In den kleinen Vesikeln haben wir außerdem microRNA gefunden, sehr kurze RNA-Stückchen, die bei der Genregulation mitspielen“, ergänzt Prof. Dr. René Ketting vom Institut für Molekulare Biologie (IMB), der ebenfalls an den Arbeiten beteiligt war. Die Vermutung ist, dass microRNA für den korrekten Ablauf der Signalkette in den Zellen entscheidend ist.
Helen May-Simera, geboren 1981 in Großbritannien, studierte Biochemie an der University of Bath. Nach Stationen als Doktorandin am University College London und als Postdoc am National Institute of Health in Bethesda, USA, erhielt sie 2014 den Sofja Kovalevskaja-Preis der Alexander von Humboldt-Stiftung, mit dem sie als Nachwuchsgruppenleiterin nach Mainz kam. Sie ist seit Februar 2021 Universitätsprofessorin der JGU.
(Johannes Gutenberg-Universität Mainz)
Originalpublikation:
Ann-Kathrin Volz et al.
Bardet-Biedl syndrome proteins modulate the release of bioactive extracellular vesicles
Nature Communications, 27. September 2021
DOI: 10.1038/s41467-021-25929-1
https://www.nature.com/articles/s41467-021-25929-1
Jonathan Eintracht et al.
Translational readthrough of ciliopathy genes BBS2 and ALMS1 restores protein, ciliogenesis and function in patient fibroblasts
EBioMedicine, 5. August 2021
DOI: 10.1016/j.ebiom.2021.103515
https://www.sciencedirect.com/science/article/pii/S235239642100308X?via%3Dihub