Um zu verstehen, wie die synaptische Aktivität trotz Alterung aufrecht erhalten werden kann, haben Göttinger Wissenschaftler*innen erstmals ein mathematisches Modell des synaptischen Vesikel-Zyklus erstellt und ihre theoretischen Erkenntnisse experimentell mit einer Kombination aus Fluoreszenz-Bildgebung und Sekundärionen-Massenspektrometrie überprüft. Geleitet wurde das Team von Prof. Dr. Silvio O. Rizzoli, Direktor des Instituts für Neuro- und Sinnesphysiologie der Universitätsmedizin Göttingen (UMG), Sprecher des Zentrums für Biostructural Imaging of Neurodegeneration (BIN), und Dr. Viola Priesemann, Gruppenleiterin am Max-Planck-Institut für Dynamik und Selbstorganisation, Angehörige der Fakultät für Physik der Georg-August-Universität Göttingen und des Bernstein-Zentrums für Computational Neuroscience.
Mittels mathematischer Modellierung des synaptischen Vesikel-Zyklus konnten sie zeigen, dass Synapsen theoretisch bedarfsabhängig mit neu gebildeten synaptischen Vesikeln versorgt werden. Die Alterung der synaptischen Komponenten wird dadurch kompensiert und die synaptische Aktivität gewährleistet. Diese positive Wechselbeziehung zwischen dem Lebenszyklus synaptischer Proteine und synaptischer Aktivität spiegelt sich auch auf der Ebene der einzelnen Synapse wider. Wurde der Transport zur Synapse unterbrochen, hob sich diese Beziehung auf. Dies deutet darauf hin, dass der synaptische Proteintransport eine wichtige Rolle bei der bedarfsabhängigen Vesikelversorgung spielt.
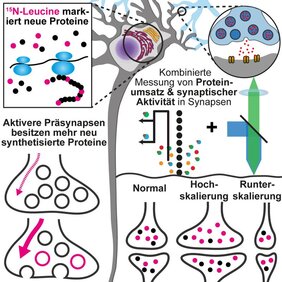
Synaptische Vesikel unterliegen einer aktivitätsabhängigen Alterung: Je öfter sie recycelt werden, desto schneller altern sie und müssen aus dem aktiven Vesikelpool entfernt werden. Dies lässt vermuten, dass eine hochaktive Synapse mehr Vesikel verbraucht und auf einen höheren Nachschub an neu gebildeten synaptischen Vesikeln angewiesen ist, um ihre Aktivität aufrechtzuerhalten, als weniger aktive Synapsen. Um diese Hypothese zu bestätigen, führten die Göttinger Wissenschaftler*innen zunächst eine mathematische Modellierung synaptischer Vesikel durch. Dabei fanden sie heraus, dass Synapsen theoretisch tatsächlich eine bedarfsabhängige Versorgung mit synaptischen Vesikeln benötigen, um die aktivitätsabhängige Alterung zu kompensieren. Im Modell erscheinen Synapsen bei einem konstanten Nachschub an neuen synaptischen Vesikeln sehr heterogen, da sie entweder synaptische Vesikel anhäufen oder verlieren, was zu einer Fehlfunktion führen würde.
Die Wissenschaftler*innen überprüften die Erkenntnisse aus ihrem Modell mit einer Kombination aus Fluoreszenz-Bildgebung und Sekundärionen-Massenspektrometrie (nanoSIMS). Die Kombination dieser beiden Methoden erlaubt es, die Lebenszeit von Proteinen und die synaptische Aktivität in einzelnen Synapsen zu untersuchen. In vergleichenden Messungen einzelner Synapsen fanden die Wissenschaftler*innen ihre Annahme bestätigt: Es zeigte sich, dass aktivere Präsynapsen auch mehr neu synthetisierte Proteine aufweisen. Eine solche Korrelierung ließ sich in der Postsynapse nicht nachweisen. Eine Unterbrechung des Vesikeltransports sowie eine chronische Erhöhung oder Verringerung der synaptischen Aktivität hob diese Korrelation auf. Diese Beobachtung deutet wiederum darauf hin, dass die bedarfsabhängige Versorgung mit neu gebildeten synaptischen Proteinen eng mit der synaptischen Aktivität verknüpft ist.
„Die Kombination aus mathematischer Modellierung, Fluoreszenzmikroskopie und Sekundärionen-Massenspektrometrie erlaubte es uns zu zeigen, dass Synapsen in Abhängigkeit von ihrer Aktivität mit neu gebildeten Vesikeln versorgt werden“, sagt Prof. Dr. Silvio Rizzoli, einer der Senior-Autor*innen der Studie. „Die zugrunde liegenden regulatorischen Mechanismen und die beteiligten molekularen Komponenten sind allerdings nicht bekannt und sollten im Fokus weiterer Studien stehen. Sehr wahrscheinlich ist, dass eine Störung dieser Regulation schwerwiegende Folgen für die einzelne Zelle und das Nervensystem haben würde.“
Das Göttinger Exzellenzcluster 2067 Multiscale Bioimaging: Von molekularen Maschinen zu Netzwerken erregbarer Zellen (MBExC) wird seit Januar 2019 im Rahmen der Exzellenzstrategie des Bundes und der Länder gefördert. Mit einem einzigartigen interdisziplinären Forschungsansatz untersucht MBExC die krankheitsrelevanten Funktionseinheiten elektrisch aktiver Herz- und Nervenzellen, von der molekularen bis hin zur Organebene. Hierfür vereint MBExC zahlreiche universitäre und außeruniversitäre Partner am Göttingen Campus. Das übergeordnete Ziel: den Zusammenhang von Herz- und Hirnerkrankungen zu verstehen, Grundlagen- und klinische Forschung zu verknüpfen und damit neue Therapie- und Diagnostikansätze mit gesellschaftlicher Tragweite zu entwickeln.
Universität Göttingen
Originalveröffentlichung: Presynaptic activity and turnover are correlated at the single-synapse level. Sebastian Jähne, Fabian Mikulasch, Helge GH Heuer, Sven Truckenbrodt, Paola Agüi-Gonzalez, Katharina Grewe, Angela Vogts, Silvio O. Rizzoli, Viola Priesemann, Cell Reports, Volume 34, Issue 11, 16 March 2021, 108841.