Ein spezielles Enzym – die sogenannte Ubiquitin-selektive Unfoldase p97/VCP – ist einer der Hauptakteure, wenn Zellen fehlgebildete oder überschüssige Proteine aus ihrem Inneren entfernen. Das ist das zentrale Ergebnisse einer neuen Studie, deren Ergebnisse jetzt in der Fachzeitschrift Nature Communications veröffentlicht wurden.
Die neuen Erkenntnisse bilden die Grundlage für ein besseres Verständnis zahlreicher krankhafter Vorgänge. Sie zeigen deutlich, dass eine Blockade dieses Enzyms dazu führt, dass sich Proteine falsch falten und Aggregate bilden, die bei neurodegenerativen Krankheiten wie Alzheimer, Parkinson und Chorea Huntington eine Rolle spielen könnten.
Verantwortlich für diese Studie ist ein Team um den Biochemiker Alexander Buchberger, Professor am Biozentrum der Julius-Maximilians-Universität Würzburg (JMU). Mit daran beteiligt waren Bettina Warscheid, ebenfalls Professorin am Biozentrum der JMU, und J. Wade Harper von der Harvard Medical School in Boston. Durchgeführt wurde die Studie im Rahmen des Graduiertenkollegs 2243 „Understanding Ubiquitylation: From Molecular Mechanisms to Disease".
Komplizierte Systeme zur Kontrolle der Proteinqualität
Tatsächlich sind die Zellen der meisten Lebewesen, und somit auch die von Menschen, im Prinzip winzig kleine Proteinfabriken. Permanent werden in ihrem Inneren neue Proteine hergestellt, zusammengesetzt, an andere Orte transportiert, wieder abgebaut. Dabei ist es von großer Bedeutung, dass diese Prozesse gut ausbalanciert ablaufen, denn schon kleine Veränderungen können schwere Erkrankungen zur Folge haben.
„Damit dies nicht passiert, haben Zellen komplizierte Systeme zur Kontrolle der Proteinqualität entwickelt“, erklärt Alexander Buchberger. Beispielsweise können sie Proteine, die zum Verklumpen neigen, in einer Art Käfig, dem so genannten Aggresom, auffangen und isolieren. Anschließend zerlegen sie diese Behälter samt Inhalt in mehrere Teile und bauen diese über verschiedene Wege ab – ein Vorgang, der in der Wissenschaftssprache Aggrephagie genannt wird.
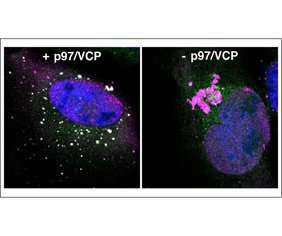
„Während die Bildung von Aggresomen sehr detailliert untersucht wurde, sind ihr Proteingehalt und ihre Abbauwege bislang nur unzureichend charakterisiert gewesen“, sagt der Biochemiker. Mit der jetzt veröffentlichten Studie ändert sich das. Buchberger und sein Team konnten nachweisen, dass das Zerlegen von Aggresomen mehrere Beteiligte erfordert. Als der bedeutendste darunter erwies sich die Ubiquitin-selektive Unfoldase p97/VCP.
In den Experimenten zeigte sich unter anderem, dass Aggresome nicht mehr zerfallen und vernichtet werden, wenn die Forscherinnen und Forscher zuvor p97/VCP blockiert hatten. „Das deutet darauf hin, dass die kritische Funktion von p97/VCP bei der Beseitigung von Aggresomen deren Zerlegung in kleinere Bestandteile ist“, so das Fazit der Gruppe.
Potenzieller Auslöser zahlreicher Krankheiten
Die Ergebnisse sind in mehrfacher Hinsicht biomedizinisch relevant: Zum einen verursachen Mutationen in dem Enzym p97/VCP neuro-muskulär degenerative Erkrankungen, wie beispielsweise bestimmte Formen von Demenz und ALS – die Amyotrophe Lateralsklerose. Zum anderen könnte auch Morbus Parkinson die Folge gestörter Abbauprozesse im Zellinneren sein.
Kennzeichen von Parkinson sind unter anderem sogenannte Lewy-Körper. Dabei handelt es sich um rundliche Einschlüsse im Inneren von Nervenzellen, die schädliche Eiweißablagerungen enthalten, die den Stoffwechsel der Nervenzellen im Gehirn stören. Auch bei ihnen könnte es sich um entartete Aggresomen handeln, die von der Zelle nicht mehr abgebaut werden.
Dementsprechend lautet das Fazit des Forschungsteams: „Unsere Befunde deuten darauf hin, dass Mutationen im Enzym p97/VCP den Abbau von Aggresomen stören. Dies könnte zur Entstehung von Lewy-Körperchen und der Entwicklung neuro-muskulär degenerativer Erkrankungen beitragen.“
Universität Würzburg
Originalpublikation:
Körner, M., Müller, P., Das, H. et al. p97/VCP is required for piecemeal autophagy of aggresomes. Nat Commun16, 4243 (2025). doi.org/10.1038/s41467-025-59556-x