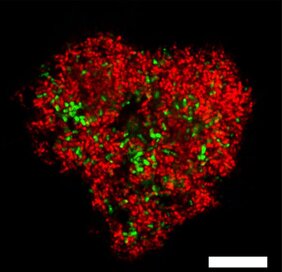
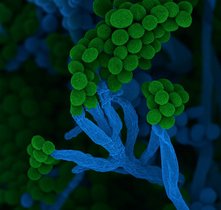
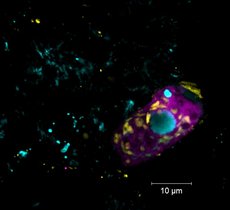
Methan, eine chemische Verbindung mit der Summenformel CH4, ist nicht nur ein starkes Treibhausgas, sondern auch eine wichtige Energiequelle. Wir heizen unsere Wohnungen damit, Mikroorganismen im Meeresboden verwenden es für ihren Stoffwechsel. Die Mikroben nutzen einen Prozess namens anaerobe Methanoxidation (AOM), der im Meeresboden häufig in sogenannten Sulfat-Methan-Übergangszonen stattfindet – Schichten im Meeresboden, in denen Sulfat aus dem Meerwasser auf Methan aus dem tieferen Meeresboden trifft. Hier verbrauchen spezialisierte Mikroorganismen, die ANaerob MEthanoxidierenden Archaeen (ANMEs), das Methan. Sie leben in enger Gemeinschaft mit Bakterien, die die bei der Methanoxidation freigesetzten Elektronen nutzen, um Sulfat zu reduzieren. Dazu bilden beide Organismen charakteristische Konsortien.
Dieser Prozess läuft weltweit im Meeresboden ab und ist daher ein wichtiger Teil des Kohlenstoffkreislaufs. Jedoch ist die anaerobe Methanoxidation äußerst mühsam zu erforschen, da die Reaktion sehr langsam abläuft. Um sie dennoch untersuchen zu können, nutzen Forschende gerne einen chemischen Kniff: die stabilen Isotopenverhältnisse im Methan. Doch leider verhalten sich diese Isotope nicht immer so wie erwartet, was zu einiger Verwirrung über die Rolle und Funktion der beteiligten Mikroben führte. Jetzt haben Forschende des Bremer Max-Planck-Instituts für Marine Mikrobiologie und des MARUM – Zentrum für Marine Umweltwissenschaften in Bremen gemeinsam mit Kollegen vom Weizmann Institute of Science in Israel dieses Isotopen-Rätsel gelöst und ihre Ergebnisse im Fachmagazin Science Advances veröffentlicht. Damit ist der Weg frei, um den wichtigen Prozess der anaeroben Methanoxidation besser zu verstehen.
Isotope verraten Reaktionswege
Das Rätsel und seine Lösung im Detail: Isotope sind verschiedene „Versionen“ eines Elements mit unterschiedlichen Massen. Verschiedene Isotope eines Elements besitzen die gleiche Anzahl an Protonen (positiv geladenen Teilchen) im Atomkern und daher die gleiche Position im Periodensystem (iso topos = griech. gleicher Ort). Sie unterscheiden sich aber in der Anzahl der Neutronen (neutrale Teilchen) im Atomkern. So gibt es etwa für Kohlenstoff zwei stabile Isotope, das leichtere 12C und das schwerere 13C. Zusätzlich gibt es das bekannte radioaktive Isotop 14C, eine sehr seltene Kohlenstoffart, die zur Bestimmung des Alters von kohlenstoffhaltigen Materialien verwendet wird. Obwohl die chemischen Eigenschaften der beiden stabilen Isotope identisch sind, verursacht der Massenunterschied unterschiedliche Reaktionsgeschwindigkeiten. Wenn chemische Verbindungen reagieren, werden jene mit leichten Isotopen in der Regel schneller umgesetzt, die schwerere Variante bleibt übrig. Diese Änderung der Isotopenzusammensetzung, genannt Isotopenfraktionierung, wird seit Jahrzehnten genutzt, um chemische Reaktionen zu verfolgen.
Im Falle der Methanoxidation würde dies also bedeuten, dass 12C-reiches Methan vorrangig verbraucht wird, was zu einer Anreicherung von 13C im verbleibenden Methan führt. Umgekehrt würde eine mikrobielle Produktion von Methan (Methanogenese) zu besonders leichtem Methan führen. „Die Realität sieht aber erstaunlich anders aus“, berichtet Gunter Wegener. „Ganz gegen die oben beschriebene Logik finden wir in Sulfat-Methan-Übergangszonen häufig sehr leichtes Methan.“
Die Natur folgt nicht dem Lehrbuch: Leichtes Methan in Sulfat-Methan-Übergangszonen
Dieses Paradoxon wirft Fragen auf, etwa: Wird dort Methan gar nicht verbraucht, sondern produziert? Und wer, wenn nicht die zahlreich vorkommenden ANME-Archaeen, sollte dafür verantwortlich sein? „In unserem Labor haben wir die weltweit größte Sammlung von ANME-Kulturen. Daran konnten wir untersuchen, ob und wie die Methanoxidierer selbst für die Bildung des leichten Methans verantwortlich sind“, fährt Wegener fort. „Die ersten Ergebnisse waren entmutigend: Bei den hohen Sulfatkonzentrationen, die wir normalerweise im Meerwasser finden, verhielten sich die kultivierten Mikroorganismen wie im Lehrbuch. Das verbleibende Methan war mit den schwereren Isotopen angereichert.“ Wurden die gleichen Versuche jedoch mit wenig Sulfat durchgeführt, reicherte sich 12C im Methan an, es wurde also leichter. Und das, obwohl gleichzeitig weiterhin Methan verbraucht wurde – ein Effekt, der auf den ersten Blick nicht zu erklären ist.
Die Verfügbarkeit von Sulfat bestimmt die Isotopeneffekte bei der AOM
Wie also kommt es zu diesem ungewöhnlichen Verhalten der Isotopenwerte? Jonathan Gropp und Itay Halevy vom Weizmann Institute of Science in Israel erforschen seit Jahren die Isotopeneffekte mikrobieller Stoffwechselvorgänge, darunter auch die Methanogenese – eine Reaktion, die von denselben Enzymen katalysiert wird wie die anaerobe Methanoxidation (AOM). Sie waren also die idealen Partner für das Team in Bremen. „Beide Prozesse beruhen auf einer sehr ähnlichen Kaskade von sieben Reaktionen“, sagt Gropp. „Frühere Studien haben gezeigt, dass alle diese Reaktionen potenziell reversibel sind. Das heißt, sie können in beide Richtungen ablaufen. Jede Reaktion hat auch ihre eigenen Isotopeneffekte.“ Mithilfe eines Isotopenmodells konnte Gropp zeigen, dass, je nachdem, wieviel Sulfat zur Verfügung steht, die Teilreaktionen in unterschiedlichem Maße umkehrbar sind. Das könnte dann dazu führen, dass die schweren Isotope nicht wie üblich zurückbleiben, sondern in der Reaktionskette steckenbleiben, während die leichten Isotope zurück zum Methan geschleust werden. „Die Mikroben wollen die Reaktion durchführen, werden aber durch die geringen Sulfatkonzentrationen daran gehindert“, erklärt Gropp und fügt hinzu: „Unser entworfenes Modell passt sehr gut zu den Isotopenexperimenten.“
Die langen Stunden im Labor und vor dem Computer haben sich für die Forschenden gelohnt. Mit ihrer Studie hat die Gruppe um Wegener und Gropp gezeigt, wie AOM zu 13C-abgereichertem Methan führt. Gerade die Experimente mit wenig Sulfat spiegeln die Bedingungen im natürlichen Lebensraum der Mikroorganismen, an der Sulfat-Methan-Übergangszone im Meeresboden, wider. Dort leben die Organismen oft mit wenig Sulfat, wie in den entsprechend durchgeführten Experimenten. „Jetzt wissen wir, dass Methanoxidierer für die Anreicherung der leichten Isotope im Methan an Sulfat-Methan-Übergangszonen verantwortlich sein können. Methanogenese ist dafür nicht erforderlich. Wie wir vermutet haben, handelt es sich bei den ANME um Methanoxidierer“, schließt Marcus Elvert, Letztautor der aktuellen Studie. Nun sind die Forscher bereit für den nächsten Schritt und wollen herausfinden, ob andere Reaktionen ähnliche Isotopeneffekte zeigen.
Max-Planck-Institut für Marine Mikrobiologie
Originalpublikation:
Gunter Wegener, Jonathan Gropp, Heidi Taubner, Itay Halevy, Marcus Elvert (2021): Sulfate-dependent reversibility of intracellular reactions explains the opposing isotope effects in the anaerobic oxidation of methane. Science Advances (2021)
DOI: 10.1126/sciadv.abe4939