Enzyme sind Biokatalysatoren, die praktisch alle zellulären Reaktionen, d.h. die Umwandlung einer Substanz (Substrat) in eine andere Substanz (Produkt), beschleunigen und dadurch Leben in der uns bekannten Form erst möglich machen. Chemisch gehören Enzyme zu den Proteinen (Eiweißmolekülen) und bestehen aus einer Kette von Aminosäuren, deren Abfolge ihre Raumstruktur und damit auch ihre jeweilige Funktion festlegt. Besonders wichtig für die Funktion sind die so genannten „aktiven Zentren“ von Enzymen. Sie bestehen aus einigen wenigen Aminosäuren, die das Substrat binden und ins Produkt umsetzen. Viele Substrate kommen in zwei so genannten enantiomeren Formen vor, die sich wie Bild und Spielegelbild zueinander verhalten. Wichtig ist, dass in der Regel nur eines der beiden Enantiomere durch das aktive Zentrum gebunden und umgesetzt wird, eine Eigenschaft die „Enantioselektivität“ genannt wird.
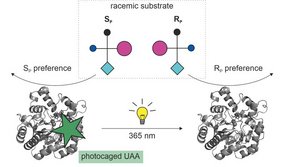
Wegen ihrer hohen Leistungsfähigkeit eignen sich Enzyme auch für Anwendungen in industriellem oder medizinischem Umfeld. Dazu ist es jedoch erforderlich, ihre Aktivitäten gezielt zu modifizieren und zu steuern. Dies geschieht mittels Proteinengineering, wobei eine der 20 natürlich vorkommenden Aminosäuren gezielt gegen eine andere ausgetauscht wird. Durch eine Umprogrammierung des für die Herstellung von Proteinen zuständigen zellulären Apparates können seit kurzem natürliche Aminosäuren auch durch in Zellen nicht vorkommende (unnatürliche) Aminosäuren (UAS) ersetzt werden. Dadurch ergeben sich neue Möglichkeiten zur Etablierung und Steuerung von Enzymaktivitäten. Eine besonders interessante Option stellen dabei photo-sensitive UAS dar, die in der Nähe des aktiven Zentrums von Enzymen eingebaut werden und dadurch Einfluss auf Substratbindung und Katalyse nehmen. Diese Technik wurde im Rahmen der hier besprochenen Arbeit auf das Enzym Phosphotriesterase (PTE) angewendet, welche enantioselektiv toxische Substrate mit Organophosphatanteilen zu ungiftigen Produkten abbaut.
Nach dem Einbau der UAS am aktiven Zentrum der PTE wurde zunächst nur eines der beiden Enantiomere gebunden. Wurde die Probe anschließend mit ultraviolettem Licht bestrahlt und dadurch die chemische Zusammensetzung der UAA geändert, konnte stattdessen das andere Enantiomer gebunden und ins Produkt umgesetzt werden. Somit konnte am Beispiel der PTE erstmals die Enantioselektivität eines Enzyms durch Licht artifiziell gesteuert werden. Diese Daten wurden durch eine anschließende detaillierte bioinformatische Analyse auf der Basis der Raumstruktur der PTE und der Veränderung des aktiven Zentrums durch die UAS erklärt. Diese Ergebnisse eröffnen neue Möglichkeiten der exakten räumlich-zeitliche Kontrolle von biochemischen Transformationen mit potenziellen Anwendungsmöglichkeiten in der pharmazeutisch-chemischen Industrie.
Universität Regensburg
Originalpublikation:
Caroline Hiefinger, Gabriel Zinner, Torben F. Fürtges, Tamari Narindoshvili, Sebastian Schindler, Astrid Bruckmann, Till Rudack, Frank M. Raushel, Reinhard Sterner (2025). Photo-Controlling the Enantioselectivity of a Phosphotriesterase via Incorporation of a Light-Responsive Unnatural Amino Acid. JACS Au 5, 858-870.
https://doi.org/10.1021/jacsau.4c01106