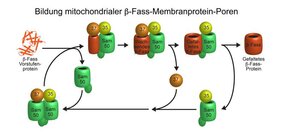
Für den menschlichen Körper sind Mitochondrien als Zellkraftwerke lebensnotwendig: Sie besitzen mehr als 1.000 verschiedene Proteine, die für viele zentrale Stoffwechselwege wichtig sind. Störungen führen zu schweren Krankheitsbildern insbesondere des Nervensystems und des Herzens. Um Proteine und Stoffwechselprodukte transportieren zu können, enthalten Mitochondrien eine spezielle Gruppe von so genannten Beta-Fass-Membranproteinen, die Transport-Poren in der Außenmembran bilden. Bisher konnten Wissenschaftlerinnen und Wissenschaftler jedoch noch nicht erklären, wie die Sortierungs- und Assemblierungs-Maschinerie (SAM) diese Beta-Fass-Proteine bildet. Einem Team um Prof. Dr. Toshiya Endo von der Universität Kyoto/Japan sowie Prof. Dr. Nils Wiedemann und Prof. Dr. Nikolaus Pfanner von der Universität Freiburg und Prof. Dr. Thomas Becker von der Universität Bonn ist es nun gelungen, die Struktur und die Funktion des SAM-Komplexes aufzuklären. Ihre Ergebnisse haben sie in der Zeitschrift „Nature“ publiziert.
Der SAM-Komplex besteht typischerweise aus zwei Beta-Fass-Untereinheiten mit dem Namen Sam50, die auf ihrer Außenseite wiederum von den Untereinheiten Sam35 und Sam37 bedeckt werden. Die Forschenden fanden heraus, dass der SAM-Komplex, während er ein neues Beta-Fass-Protein bildet, nur ein Sam50 enthält. Die zweite Beta-Fass-Untereinheit wirkt als flexibler Platzhalter: Sie verlässt vorübergehend den SAM-Komplex und gibt den Platz für das neu zu bildende Beta-Fass-Protein frei. Dieser dynamische Mechanismus erklärt, wie ein neues Beta-Fass-Protein bis zur vollen Größe im SAM-Komplex heranreifen kann und erst als fertig gefaltetes Protein entlassen wird. „Damit konnte ein neues Prinzip für die Bildung von Membranproteinen gefunden werden, die lebenswichtige Funktionen in unseren Zellen ausüben“, erläutert Wiedemann.
Albert-Ludwigs-Universität Freiburg
Originalpublikation:
Takeda, H., Tsutsumi, A., Nishizawa, T., Lindau, C., Busto, J.V., Wenz, L.S., Ellenrieder, L., Imai, K., Straub, S.P., Mossmann, W., Qiu, J., Yamamori, Y., Tomii, K., Suzuki, J., Murata, T., Ogasawara, S., Nureki, O., Becker, T., Pfanner, N., Wiedemann, N., Kikkawa, M., Endo, T. (2021): Mitochondrial sorting and assembly machinery operates by β-barrel switching. In: Nature. DOI: 10.1038/s41586-020-03113-7