Die weltweite Nahrungsmittelproduktion muss sich bis zum Jahr 2050 verdoppeln, um die bis dahin erwarteten zusätzlichen zwei Milliarden Menschen auf der Erde zu ernähren. Die Steigerung der Nahrungsmittelproduktion erfordert Ertragssteigerungen bei vielen unserer Grundnahrungsmittel. Es müssen Strategien entwickelt werden, mit denen wir Pflanzen widerstandsfähiger gegen eine Vielzahl mikroskopisch kleiner Schaderreger wie Bakterien, Pilze und Viren machen und gleichzeitig sicherstellen können, dass die Nahrungsmittelproduktion ökologisch unbedenklich ist. Um dies zu erreichen, ist ein tiefes Verständnis des pflanzlichen Immunsystems wichtig, d. h. der Abwehrmechanismen, die Pflanzen einsetzen, wenn sie mit eindringenden Mikroorganismen konfrontiert werden.
In zwei bahnbrechenden Studien haben Wissenschaftler und Wissenschaftlerinnen unter der Leitung von Jijie Chai und Jane Parker vom MPIPZ in Köln und der Universität zu Köln, in Zusammenarbeit mit den Gruppen um Junbiao Chang von der Zhengzhou-Universität in Zhengzhou und Zhifu Han von der Tsinghua-Universität in Peking zwei Klassen von Molekülen identifiziert und ihre Wirkungsweise bei der Vermittlung von Immunreaktionen in Pflanzenzellen bestimmt. Ihre Ergebnisse ebnen den Weg für die Entwicklung bioaktiver kleiner Moleküle, die die Widerstandsfähigkeit von Pflanzen gegen schädliche Mikroben im Feld aktivieren.
Auf molekularer Ebene sind bei der Immunabwehr der Pflanzen Proteine beteiligt, die als nukleotidbindende Domäne und leucinreiche repeat Rezeptoren (NLRs) bezeichnet werden. Die zugehörigen Gene dieser NLRs werden seit Jahrzehnten von Pflanzenzüchtern aus Wildformen in Nutzpflanzen eingekreuzt und vermitteln einen wirksamen Schutz gegen einen bestimmten Schaderreger, bspw. einen Rostpilz. NLRs werden durch eindringende Mikroorganismen aktiviert und setzen schützende Immunreaktionen in Gang. Diese Immunreaktionen gipfeln oft in einer ‚hypersensitiven Reaktion‘, die das Wachstum des Erregers einschränkt und zum raschen Absterben von Pflanzenzellen am Ort der Infektion führt - vergleichbar mit der Amputation eines Zehs, um das Überleben des Körpers sicherzustellen.
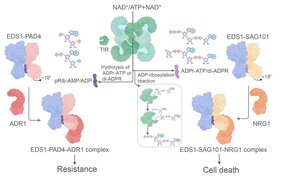
Eine Klasse von NLR-Proteinen, diejenigen mit so genannten Toll/Interleukin-1-Rezeptor (TIR)-Domänen, die als TIR-NLRs (oder TNLs) bezeichnet werden, leiten Signale an das nachgeschaltete Immunprotein Enhanced Disease Susceptibility 1 (EDS1) weiter. Kleinere TIR-haltige Proteine geben ebenfalls Signale an EDS1 weiter, um die Abwehr zu erhöhen. EDS1 agiert als Kontrollzentrum indem es mit bestimmten weiteren Proteinen assoziiert und diese EDS1 Komplexe dann erst Pflanzenzellen veranlassen, Immunantworten zu aktivieren, die das Wachstum von Krankheitserregern beenden oder den Zelltod von Wirtszellen auslösen. Frühere Arbeiten haben gezeigt, dass TNL-Rezeptoren und TIR-Proteine tatsächlich durch Schaderregerbefall aktivierte Enzyme sind. Es gab Vermutungen, dass diese TIR-Enzyme einen oder mehrere kleine Botenstoffe produzieren, die EDS1 in den Zellen ein Signal geben. Die Identität der von TNLs oder durch TIRs erzeugten Moleküle, die die Immunreaktionen stimulieren, blieb jedoch rätselhaft.
Die Gruppe um Parker stellte fest, dass zwei unterschiedliche EDS1 enthaltende Proteinkomplexe, die entweder zur Immunität oder zum Wirtszelltod führen, sich erst durch die vom Schaderreger aktivierten TNL-Enzyme in Pflanzenzellen zusammenlagern. Um die kleinen Moleküle zu identifizieren, die von TNLs oder TIRs produziert werden und als Botenstoffe auf EDS1 einwirken, stellte die Chai-Gruppe die Schlüsselkomponenten des gesamten Immunsignalweges der Pflanze in Insektenzellen nach. Dies ermöglicht die Produktion und Reinigung großer Mengen von Molekülen, die dann isoliert und charakterisiert werden können. Mit diesem radikal vereinfachten experimentellem System entdeckten die Autoren zwei verschiedene Klassen von modifizierten Nukleotidmolekülen, die von TNLs und TIRs produziert werden und zuvor in keinem lebenden Organismus beschrieben wurden. Diese kleinen Moleküle binden jeweils hochspezifisch an eine der beiden EDS1 enthaltenden Proteinkomplexe und bewirken die Zusammenlagerung noch größerer immunoaktiver EDS1 Protein-Funktionseinheiten. Damit zeigen die Autoren, dass verschiedene EDS1 enthaltende Komplexe in Pflanzenzellen durch neuartige von TIR produzierte Botenstoffe aktiviert werden, um wirksame Immunreaktionen auszulösen.
Die TIR-Immunrezeptoren und EDS1 Proteinkomplexe kommen in vielen wichtigen Nutzpflanzen wie Reis und Weizen vor. Jijie Chai weist darauf hin, dass "die identifizierten TIR-katalysierten kleinen Moleküle als natürliche Immunstimulanzien zur Bekämpfung von Pflanzenkrankheiten eingesetzt werden können". Jane Parker merkt weiter an, dass "die Kenntnis der biochemischen Wirkungsweise dieser kleinen Moleküle ein ganz neues Kapitel für die Steuerung der Pflanzenabwehr und Schaderreger-Kontrolle eröffnet".
MPIPZ
Originalpublikationen:
Jia, A., Huang, S., Song, W., Wang, J., Meng, Y., Sun, Y., et al.: TIR-catalyzed ADP-ribosylation reactions produce signaling molecules for plant immunity. Science 7 July 2022, DOI: 10.1126/science.abq8180
Huang, S., Jia, A., Song, W., Hessler, G., Meng, Y., Sun, Y., et al.:Identification and receptor mechanism of TIR-catalyzed small molecules in plant immunity.Science 7 July 2022, DOI: 10.1126/science.abq3297