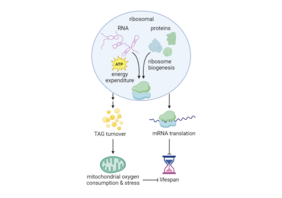
Ribosomen sind zelluläre Organellen, die als Proteinsynthese-Fabriken eine zentrale Rolle in alle lebenden Organismen spielen. Diese winzigen Strukturen bestehen selber aus Ribonukleinsäure (RNA) und Proteinen und sind essentiell für das Überleben und Funktionieren der Zelle, da die von ihnen produzierten Proteine für nahezu alle zellulären Prozesse benötigt werden, einschließlich der Struktur, Funktion und Regulation.
Die Produktion von Ribosomen beginnt mit der Aktivität von RNA-Polymerase I (Pol I). Pol I stellt die pre-rRNA, ein Vorläufer-Transkript der ribosomale RNA (rRNA), die nach Reifung Bestandteil von Ribosomen wird, her. Obwohl bereits gezeigt wurde, dass die reduzierte Aktivität von Pol I mit einem längeren Leben zusammenhängt, fehlte bisher eine genaue Erklärung dafür. Eine in „Nature Communications“ veröffentlichten Studie hat nun gezeigt, dass eine Verringerung der Pol I-Aktivität beim Fadenwurm Caenorhabditis elegans die Funktion der Mitochondrien verbessert und den Stoffwechsel stabilisiert, was wiederum die Lebensdauer verlängert. Diese Erkenntnisse haben auch Auswirkungen auf menschliche Zellen.
Möglich wurde diese Studie zum einen durch die Expertise auf dem Gebiet Metabolismus und Altern in Zellen und Organismen von Maria Ermolaevas Forschungsgruppe „Stresstoleranz und Homöostase“ am Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena. Zum anderen war Holger Bierhoffs Forschungsgruppe „Epigenetik des Alterns“, die sowohl mit der Friedrich-Schiller-Universität Jena als auch mit dem FLI assoziiert ist, mit ihrer Erfahrung bei der Pol I-Transkription und Ribosomenbiogenese eine treibende Kraft.
Die rRNA-Synthese und die Ribosomenbiogenese verbrauchen zusammen bis zu 60 Prozent der zellulären Energie. Entsprechend unterstützt die Arbeit des Forschungsteams die Idee, dass die Hemmung von Pol I den Energieverbrauch senkt und somit den Stoffwechsel länger aufrecht erhält, was wiederum die Lebensspanne verlängert. Interessanterweise erzeugt die Verminderung der Pol I-Aktivität nicht nur einen ATP-Überschuss, der für zellulären Reinigungs- und Reparaturmechanismen zur Verfügung steht, sondern bewirkt auch eine metabolische Umstellung, die den Verbrauch von Triglyceriden und mitochondriale Atmung drosselt. Da die mitochondriale Atmung eine Hauptquelle reaktiver Sauerstoffspezies (ROS) und mitochondrialer Schäden während des Alterns ist, bewirkt die Reduktion der Atmung einen Anti-Aging-Effekt.
Die Forscher haben durch genetisch Veränderungen auch die Erhöhung der Pol I-Aktivität in C. elegans untersucht. Während diese Tiere anfangs einen Fitnessvorteil hatten, da sie größer und neuromuskulär leistungsfähiger waren, verschlechterte sich ihr Stoffwechsel rapide mit dem Alter, was zum vorzeitigen Tod führte. Darüber hinaus wurde gezeigt, dass die Verminderung der Pol I-Aktivität auch im hohen Alter noch gesundheitsfördernd und lebensverlängernd wirkt.
"Es war überraschend, eine Langlebigkeitsintervention zu entdecken, die im hohen Alter wirksam ist. Frühere Arbeiten von uns und anderen Forscherteams haben das hohe Alter als einen begrenzenden Faktor für die Wirksamkeit bekannter Interventionen wie Metformin und Fasten bestimmt ", sagt Maria Ermolaeva. "Es war auch spannend zu entdecken, dass eine geroprotektive Intervention wirkt, indem sie den Energiestoffwechsel aktiv unterdrückt. Studien an sehr langlebigen Arten wie dem Grönlandwal und dem Nacktmull haben eine reduzierte Energieumwandlung als einen ihrer genetischen Vorteile identifiziert. Jetzt haben wir eine Intervention entdeckt, die dieses positive Merkmal potenziell beim Menschen replizieren kann."
Holger Bierhoff ergänzt: „Das Risiko an Krebs zu erkranken steigt mit zunehmendem Alter und Krebs ist fast immer mit einer Erhöhung der rRNA-Synthese und Ribosomenbiogenese verbunden. Eventuell kann eine moderate Verringerung der rRNA-Synthese, insbesondere im Alter, eine Möglichkeit darstellen, nicht nur die Stoffwechselgesundheit zu verbessern, sondern auch das Krebsrisiko zu senken".
Schließlich ist ein weiteres Fazit der Studie, dass eine übermäßige Zufuhr von Nahrungsproteinen - eine gängige Selbstintervention, die in Kombination mit Kraftsport das Muskelwachstum fördern soll - potenziellen Risiken birgt, da sie auch die Pol I-Aktivität stimuliert. Ähnlich wie bei den Fadenwürmern mit genetisch verstärkter rRNA-Synthese, könnte die Gefahr bestehen, dass eine exzessive Proteinzufuhr kurzfristig die körperliche Fitness verbessert, langfristig aber den metabolischen Alterungsprozess beschleunigt und möglicherweise die Organfunktion im späteren Leben beeinträchtigt.
Die Studie liefert wichtige Erkenntnisse über die molekularen Mechanismen, die der Langlebigkeit zugrunde liegen. Eine gezielte Regulation der Pol I-Aktivität könnte potenziell neue Wege für die Entwicklung von Therapien zur Förderung gesunden Alterns eröffnen.
Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI)
Originalpublikation:
Sharifi, S., Chaudhari, P., Martirosyan, A. et al. Reducing the metabolic burden of rRNA synthesis promotes healthy longevity in Caenorhabditis elegans. Nat Commun15, 1702 (2024). doi.org/10.1038/s41467-024-46037-w