Weltweit steht etwa jeder sechste Todesfall in Zusammenhang mit einer Krebserkrankung. Zu den bekanntesten Behandlungsmethoden zählen Chemo- und Immuntherapie. Die Wirkungsweise dieser Therapien setzt darauf, dass sich die Krebszellen nicht weiter teilen oder das Immunsystem dabei unterstützt wird, die Tumorzellen abzutöten. Doch trotz der heutzutage gut entwickelten Antikrebstherapien ist die Effizienz oft nicht so hoch wie gewünscht.
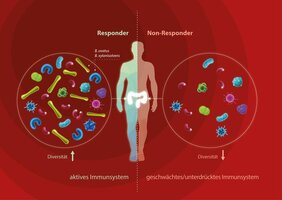
„Alle Daten deuten darauf hin, dass das Darmmikrobiom, also die Gesamtheit aller Mikroorganismen, die in unserem Darm leben, für den Therapieerfolg eine wichtige Rolle spielt“, sagt Gianni Panagiotou vom Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie in Jena. Mit seinem Team analysierte er Stuhlproben mehrerer Krebspatienten, die mit Chemo- oder einer Kombination aus Chemo- und Immuntherapie behandelt wurden. Obwohl die Versuchsgruppe mit Patienten mit acht verschiedenen Krebsarten klein war, gelang es den Forschern bei der Stuhlanalyse einige Gemeinsamkeiten festzustellen: „Die Darmmikrobiome derjenigen Krebspatienten, die gut auf die Therapie ansprachen, weisen eine größere mikrobielle Vielfalt auf. Außerdem unterscheiden sich ihre im Darm vorkommenden Bakterienspezies von denen jener Patienten, die weniger gut auf die Therapiemaßnahmen reagierten“, so Panagiotou. In Patienten mit Therapieerfolg wurden die Spezies Bacteroides ovatus und Bacteroides xylanisolvens vermehrt gefunden, wohingegen Clostridium symbiosum und Ruminococcus gnavus vermehrt bei Patienten vorkamen, bei denen die Antikrebstherapie weniger erfolgreich verlief.
Mithilfe der gewonnenen Erkenntnisse entwickelten die Forscher um Panagiotou ein auf maschinellem Lernen basierendes Vorhersagemodell: Es soll langfristig ermöglichen, vor Therapiebeginn die Wahrscheinlichkeit für eine erfolgreiche Antikrebsbehandlung unabhängig von der Art der Krebserkrankung zu errechnen. Nachdem die Wissenschaftler das Modell mit den bereits gesammelten Daten gespeist hatten, testeten sie die Richtigkeit der Vorhersagen anhand einer Vergleichsgruppe. Bei der Überprüfung bewies das Modell eine hohe Voraussagegenauigkeit. „Allerdings war unsere Vergleichsgruppe bisher klein. Unsere nächste Aufgabe ist also, die bisherigen Ergebnisse durch eine größere Anzahl an Vergleichsdaten zu bestätigen“, sagt Panagiotou. Gemeinsam mit zahlreichen Kolleginnen und Kollegen erforscht er im Jenaer Exzellenzcluster Balance of the Microverse die Mechanismen, mit denen Mikrobiome und ihre Umwelt wechselwirken.
Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie - Hans-Knöll-Institut (HKI)
Originalpublikation:
Heshiki Y, Vazquez-Uribe R, Li J, Ni Y, Quainoo S, Imamovic L, Li J, Sørensen M, Chow BKC, Weiss GJ, Xu A, Sommer MOA, Panagiotou G (2020) Predictable modulation of cancer treatment outcomes by the gut microbiota. Microbiome 8(1):28. doi: 10.1186/s40168-020-00811-2.
https://doi.org/10.1186/s40168-020-00811-2