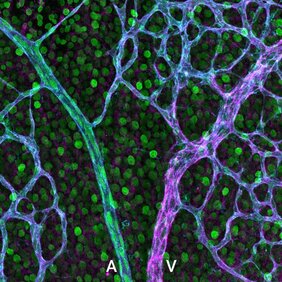
Im Mittelpunkt dieser Entdeckung stehen zwei Schlüsselmoleküle: EphB4 und Ephrin-B2. Traditionell ist EphB4, ein Transmembranrezeptor, in den Endothelzellen des venösen Systems exprimiert, während ephrin-B2, ein Transmembranligand, in arteriellen Endothelzellen dominiert. Interessanterweise haben neuste Studien ihre gemeinsame Expression in Tip-Zellen aufgedeckt, den Leitzellen des vaskulären Wachstums. "Stellen Sie sich das sich entwickelnde Gefäßsystem des Körpers als expandierendes Netzwerk von Straßen vor, wobei Arterien als lebenserhaltende Autobahnen für Sauerstoff und Nährstoffe fungieren. Am Rand des Netzwerks befinden sich Tip-Zellen, die die Expansion in neue Gebiete leiten", erklärt Mara Pitulescu, leitende Wissenschaftlerin in der Abteilung von Ralf Adams. Pitulescus frühere Forschung zeigte die bemerkenswerte Fähigkeit von Tip-Zellen, sich in arterielle Vorläuferzellen umzuwandeln. Indem sie gegen den Blutfluss wandern, dienen diese Zellen als Bausteine, die in Arterien eingebaut werden und somit deren Wachstum fördern.
Auf der Suche nach den molekularen Mechanismen, die der arteriellen Spezifizierung von Tip-Zellen zugrunde liegen, analysierten Mara Pitulescu und Doktorand Jonas Stewen die retinalen Blutgefäße von Mausmutanten sowie Zellkulturmodelle, in denen die Signalübertragung von EphB4 oder Ephrin-B2 beeinträchtigt oder verstärkt ist. "Wir haben festgestellt, dass sich EphB4 und Ephrin-B2 gegenseitig hemmen: Wenn EphB4 niedrig ist und/oder Ephrin-B2 hoch ist, wird das arterielle Programm in den Endothelzellen aktiviert", sagt Stewen. Darüber hinaus fanden die Forscher komplexe Rückkopplungsschleifen ausgehend von EphB4 und Ephrin-B2, die Notch und den vaskulären endothelialen Wachstumsfaktor (VEGF)-Signalweg aktivieren oder hemmen – bekannte Akteure, die an der arteriellen Spezifizierung beteiligt sind. "Das enge Gleichgewicht von EphB4 und Ephrin-B2 reguliert somit ein verschachteltes molekulares Netzwerk, das die arterielle Spezifizierung steuert", fügt Stewen hinzu.
Bemerkenswert ist, dass die Störung des Gleichgewichts von EphB4 und Ephrin-B2 in Tip-Zellen tiefgreifende Auswirkungen auf die Entwicklung des gesamten vaskulären Plexus hat. "Wir haben festgestellt, dass die Deletion von EphB4 sogenannte arteriovenöse Kreuzungen verursacht, eine retinale Gefäßpathologie, die bei menschlichen Patienten auftritt, wenn eine Arterie auf einer Vene liegt", sagt Pitulescu. Dies kann zu arteriovenösen Einkerbungen und folgend zu Verschlüssen der retinalen Venen führen - ein Phänomen, das zunehmend mit einem erhöhten Risiko für die Bildung von Schlaganfällen in Verbindung gebracht wird.
"Unsere Ergebnisse könnten Aufschluss über die zugrunde liegenden Mechanismen bestimmter Gefäßerkrankungen geben und möglicherweise den Weg für die Entwicklung neuartiger therapeutischer Behandlungen ebnen", erklärt Ralf Adams, Leiter der Abteilung für Gewebebiologie und Morphogenese am Max-Planck-Institut für Molekulare Biomedizin.
(Max-Planck-Institut für molekulare Biomedizin)
Originalpublikation:
Jonas Stewen, Kai Kruse, Anca T. Godoi-Filip, Zenia, Hyun-Woo Jeong, Susanne Adams, Frank Berkenfeld, Martin Stehling, Kristy Red-Horse, Ralf H. Adams and Mara E. Pitulescu.
Eph-ephrin signaling couples endothelial cell sorting and arterial specification.
Nature Communications, 3. April 2024
https://doi.org/10.1038/s41467-024-46300-0