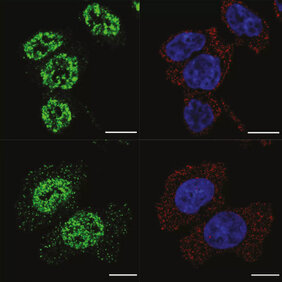
Im Laufe der Evolution wurden die Genome vieler Organismen mit alten genetischen Überbleibseln aus der Evolution oder mit Teilen von Retroviren durchsetzt, die ihren genetischen Code vor Millionen von Jahren eingefügt haben. Fast die Hälfte des menschlichen Genoms besteht aus solchen Elementen, den Transposons. Und unser Genom entwickelt sich weiter. Es gleicht eher einem in Arbeit befindlichen Dokument als einem statischen Code und verändert seine Struktur und manchmal sogar seinen Inhalt. Transposons können zwischen und innerhalb von Genen "springen", indem sie häufig Proteine kodieren, die ihre Mobilität fördern, und indem sie die Transkriptionsmaschinerie der Zelle kapern. Dies stellt eine Bedrohung dar, da Mutationen eingeführt werden. Es ist aber auch eine Quelle potenziell nützlicher Variationen in den Genen, die Evolution und Anpassung an Umweltveränderungen ermöglichen.
Ein fragiles Gleichgewicht
Da Transposons sowohl Fluch als auch Segen sind, halten Organismen und transponierbare Elemente ein fragiles Gleichgewicht aufrecht, um ihre Koexistenz zu gewährleisten. In der Keimbahn, wo Mutationen über die Geschlechtszellen an die Nachkommen weitergegeben werden können, sind Systeme bekannt, die Transposons während der Transkription stilllegen und ihre übermäßige Aktivität verhindern. „In somatischen Zellen sind Transposons bisher nur unzureichend erforscht, da sie nicht vererbt werden können und ihre Mobilität viel eingeschränkter ist“, sagt Gruppenleiterin Tugce Aktas. „Die Tatsache, dass sie weniger mobil sind, und Studien, die ihre Aktivität mit Krankheiten in Verbindung bringen, legen nahe, dass es Mechanismen geben muss, die sie in Schach halten. In unserer Studie haben wir nun einen evolutionär konservierten Mechanismus entdeckt, der die RNA-Prozessierung nutzt, um die negativen Auswirkungen der Transposons zu begrenzen.“
Eine neue Ebene der Abwehr
Bevor die transkribierte mRNA zur Herstellung von Proteinen verwendet werden kann, muss sie in einem Prozess namens „Spleißen“ von Introns befreit werden. Im Gegensatz zu Exons kodieren diese Elemente keine Aminosäuren. Transposons haben eine gemeinsame evolutionäre Geschichte mit Introns, und etwa 65 % der menschlichen Transposons sind intronisch. Wenn sie jedoch versehentlich in Gene eingebaut werden, können sie die Genexpression und die RNA-Prozessierung verändern, indem sie „exonisieren“ und Teil eines reifen mRNA-Strangs werden. Die Wissenschaftler konzentrierten sich auf L1, ein häufig vorkommendes transponierbares Element im menschlichen Genom. Sie untersuchten die Wechselwirkungen von L1 mit einer Gruppe von Proteinen, von denen bekannt ist, dass sie eine wichtige Rolle beim Spleißen spielen. Dabei entdeckten sie, dass drei so genannte SAFB-Proteine (Scaffold Attachment Factor B) an bestimmte Sequenzen dieser Transposons binden. „Als wir diese Proteine entfernten, wurden die gebundenen Teile wieder Teil der reifen mRNA-Moleküle“, erklärt Petar Glazar, Postdoktorand und einer der Erstautoren der Studie. SAFB-Proteine verhindern also effektiv die Bewegung von L1-Elementen, indem sie deren RNA-Produkte im Zellkern isolieren, wo sie später abgebaut werden. „Die meisten bekannten Mechanismen konzentrieren sich auf das transkriptionelle Silencing von Transposons“, sagt Ibrahim Avsar Ilik, Postdoktorand und Koautor der Studie. „Unsere Arbeit zeigt eine neue Ebene der Regulation von Transposons auf posttranskriptionaler Ebene. Dies ist eine bemerkenswerte Entdeckung, denn sie zeigt, wie ein bestehender zellulärer Prozess zur Bekämpfung von Transposons umfunktioniert wird. Dies veranschaulicht das evolutionäre Wettrüsten zwischen Transposons und unserem Genom.“
Mögliche physiologische Rolle
Die Daten der Wissenschaftler zeigen, dass der Prozess evolutionär konserviert ist und ähnliche Proteinfamilien in Maus, Fliege und Mensch ähnliche Aufgaben erfüllen. Ziel des Labors ist es nun, die SAFB-Proteine, deren RNA-Bindungsfähigkeit bisher weitgehend unerforscht war, weiter zu charakterisieren. Im Menschen wird die Aktivität von Transposons in Körperzellen mit Prozessen wie der Bildung von Gewebe und Nervenzellen sowie mit Krankheiten in Verbindung gebracht. SAFB-Proteine sind auch ein wichtiger Bestandteil von so genannten „nuclear stress bodies“, rätselhaften Strukturen, die von Zellen unter äußerem Stress gebildet werden. „Unser Ziel ist es nun, eine Zusammenarbeit mit anderen Experten aufzubauen, um die biochemischen und strukturellen Eigenschaften der SAFB-Proteine und ihre physiologische Bedeutung in Geweben, insbesondere im Gehirn, zu verstehen“, sagt Tugce Aktas.
Max-Planck-Institut für molekulare Genetik
Originalpublikation:
Ilık, İ.A., Glažar, P., Tse, K. et al. Autonomous transposons tune their sequences to ensure somatic suppression. Nature (2024). doi.org/10.1038/s41586-024-07081-0