Biologische Techniken zur Steuerung zellulärer Prozesse mit Hilfe von Licht werden unter dem Begriff Optogenetik zusammengefasst. Einem internationalen Forschungsteam unter Federführung der Würzburger Pflanzenwissenschaftler Rainer Hedrich, Georg Nagel und Dirk Becker ist es gelungen, diese Methode auf höhere Pflanzen anzuwenden: Durch Lichtimpulse lassen sich nun elektrische Erregungen in Pflanzen auslösen.
„Mit diesem Werkzeug können wir erstmals nicht-invasiv untersuchen, wie elektrisch basierte zelluläre Kommunikationswege in Pflanzen auf molekularer Ebene funktionieren und wie die Pflanze diese elektrischen Signale nutzt, um auf extreme Temperaturschwankungen, Insektenbefall oder andere Stressfaktoren zu reagieren“, sagt Dirk Becker.
Sind Pflanzen gestresst, senden sie weitreichende elektrische Signale aus, sogenannte Membranpotentialwellen. Damit übertragen sie Informationen schnell und präzise über weite Strecken, obwohl sie weder ein Gehirn noch Nervenzellen besitzen. Welche molekularen Mechanismen dabei ablaufen, ist weitgehend unbekannt. Neue Einblicke in diese komplexen Vorgänge liefert das Forschungsteam in der renommierten Fachzeitschrift PNAS (Proceedings of the National Academy of Sciences USA).
Algen liefern Werkzeuge für die Membranbiologie
Wie kann man in Pflanzen ein elektrisches Signal simulieren, das normalerweise durch Stress oder Verwundung ausgelöst wird, ohne dabei ungewollte Nebenreaktionen hervorzurufen?
Diese Herausforderung ging das Team mit Hilfe der Optogenetik an. Die Methode gibt es seit 2002. Für ihre Entwicklung wurden die Koautoren der aktuellen PNAS-Publikation, Georg Nagel und Ernst Bamberg, zusammen mit anderen Forschern mehrfach ausgezeichnet.
Die Optogenetik hat es möglich gemacht, die elektrische Aktivität von Nervenzellen mit Lichtimpulsen zu steuern. Zuvor werden die Nervenzellmembranen mit lichtempfindlichen Ionenkanälen aus Algen bestückt, den sogenannten Kanalrhodopsinen.
Stress führt zu Depolarisation und Ansäuerung
Höhere Pflanzen haben die lichtempfindlichen Ionenkanäle der Algen im Lauf der Evolution verloren, erklärt Dirk Becker. Nun ist es gelungen, die Gene für die Kanalrhodopsine in das Erbgut der Modellpflanze Ackerschmalwand (Arabidopsis thaliana) zurückzubringen, deren Blattzellen mit Licht gezielt zu erregen und die membranelektrische Antwort zu analysieren.
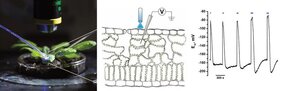
Stresst man Pflanzen, depolarisieren die gereizten Zellen und das Zellmilieu wird saurer. Das war bekannt. Wie aber lassen sich die beiden Vorgänge im Experiment simulieren? Die Würzburger Forscher verwenden dafür eine Kanalrhodopsin-Variante, die durch Blaulicht angeschaltet wird und dann Protonen in die Zelle leitet.
Normalerweise ist die Zellwand einer Pflanzenzelle um mindestens eine pH-Einheit saurer als das Zellinnere, so Rainer Hedrich. Öffnet sich der Protonenkanal, strömen zwangsläufig Protonen und damit positive elektrische Ladungen über die Zellmembran. Das depolarisiert die Membran und säuert das Zellinnere an.
Depolarisation lässt sich steuern
Um diesen Effekt experimentell auszulösen, wird ein blauer Laser auf das zu untersuchende Blattareal gerichtet und das Membranpotential der stimulierten Zellen verfolgt, erklärt Dirk Becker: „Über die Beleuchtungsstärke, Dauer und Häufigkeit der Blaulichtpulse haben wir die Form der Membrandepolarisation gesteuert und die Repolarisationsreaktion der Pflanzenzelle detailliert analysiert.“
Dabei zeigte sich, dass die Repolarisation maßgeblich durch ATP-getriebene Membranpotential-sensitive Protonenpumpen erfolgt. Wenn die Zellmembran depolarisiert, geht diese Protonenpumpe in einen Zustand erhöhter Aktivität über. Dabei befördert sie verstärkt positive geladene Protonen aus der Zelle, die Zellmembran repolarisiert.
Dieser Mechanismus unterscheidet sich grundlegend von dem in tierischen Nervenzellen, bei denen spannungsabhängige Kaliumkanäle diesen Prozess regulieren. Dass Pflanzen dies über eine Protonenpumpe und nicht über einen Kaliumkanal bewerkstelligen, konnten die Würzburger Pflanzenforscher beweisen: Eine Arabidopsis-Mutante ohne Kaliumkanal verhielt sich auf einen Lichtreiz hin wie eine normale Pflanze.
Kanalrhodopsine für alle Fälle
"Derzeit erproben wir weitere optogenetische Werkzeuge dieser Art", so Rainer Hedrich. Dabei gelte es nicht nur, die zelluläre Kommunikation durch elektrische Signale aufzuklären. Es gehe auch darum, die Bedeutung von gleichzeitig auftretenden Kalziumwellen und pH-Signalen in Pflanzen zu verstehen.
Um zu klären, was Pflanzenzellen im Allgemeinen auszeichnet und welche zellspezifisch besonderen Ausprägungen entstanden sind, wollen die Forscher Kanalrhodopsine in Zellen mit unterschiedlichsten Funktionen einbringen. Dabei sollen auch Kanalrhodopsin-Varianten mit jeweils spezifischer Ionenselektivität Einsatz finden – und Licht in das Dunkel der verschlungenen Kommunikationswege der Pflanze bringen.
Universität Würzburg
Originalpublikation:
Antonella Reyer, Melanie Häßler, Sönke Scherzer, Shouguang Huang, Jesper Torbøl Pedersen, Khaled A. S. Al-Rascheid, Ernst Bamberg, Michael Palmgren, Ingo Dreyer, Georg Nagel, Rainer Hedrich, Dirk Becker: "Channelrhodopsin-mediated optogenetics highlights a central role of depolarization-dependent plant proton pumps", PNAS, 10. August 2020