Denken, Lernen, Fühlen – Sinneswahrnehmungen werden alle im Gehirn verarbeitet. Dort sind beim Menschen etwa 100 Milliarden Nervenzellen vernetzt. Die blitzschnelle Kommunikation zwischen diesen Gehirnzellen, auch Neuronen genannt, ereignet sich maßgeblich als Signalübertragung an den Kontaktstellen, den Synapsen. Dies ist ein komplexes Zusammenspiel elektro-chemischer Prozesse, bei denen die winzigen Zwischenräume zwischen einer sendenden Zelle und der Empfänger-Zelle überbrückt werden. Der zugrundeliegende Mechanismus ist bekannt: Sehr vereinfacht gesagt, wird eine synaptische Signalübertragung ausgelöst, wenn sich in der Sender-Nervenzelle befindliche Kalzium-Ionen an spezifische Sensorproteine binden und infolge dessen Botenstoffe, sogenannte Neurotransmitter, aus der Zelle ausgeschüttet werden. Die Empfängerzelle reagiert mit einem messbaren elektrischen Signal.
Unterschiede in der Signalübertragung
Dennoch gibt es in verschiedenen Bereichen des Gehirns wesentliche Unterschiede, die sich auf die Signalübertragung auswirken können: etwa die Größe der Nervenzellen, Anzahl der Synapsen und auch die Beschaffenheit der kalziumbindenden Sensorproteine innerhalb der Zellen.
„Wir wissen schon länger, dass die Übertragung in der Großhirnrinde, also dem Kortex, sehr viel zuverlässiger erfolgt als in anderen Regionen des Gehirns“, sagt Prof. Dr. Hartmut Schmidt vom Carl-Ludwig-Institut (CLI) der Medizinischen Fakultät, Leiter der vorliegenden Studie. Der Kortex ist auch als graue Hirnmasse bekannt, der Verarbeitungszentren für verschiedene Funktionen beinhaltet, wie beispielsweise den somatosensorischen Kortex. Das ist der Bereich, in dem Sinneseindrücke vom Körper vor-verarbeitet werden, bevor sie an andere Bereiche des Kortex weitergegeben werden.
Sensorprotein entscheidend
„In unserer aktuellen Arbeit haben wir herausgefunden, dass das Sensorprotein dort, Synaptotagmin 1 genannt, bereits auf eine viel geringere Kalziumkonzentration in der Synapse reagiert und die Signalübertragung anstößt als beispielsweise das bereits seit 25 Jahren erforschte Sensorprotein in Zellen im hinteren Bereich des Gehirns, das Synaptotagmin 2“, so der Biologe. „Die Eigenschaften von Synaptotagmin 1 scheinen dazu beizutragen, dass die von uns untersuchten kortikalen Synapsen nicht nur zuverlässiger, sondern auch plastischer sind – eine Grundvoraussetzung dafür, dass sich das Gehirn innerhalb des Lebens an neue Anforderungen anpassen kann.“
Die genaue Kenntnis dieser Faktoren im gesunden Gehirn legt die Basis dafür, gestörte Prozesse etwa bei Hirnerkrankungen zu erkennen und Therapieansätze zu entwickeln. „Aber auch für die Weiterentwicklung neuronaler Netzwerke in der Computerindustrie könnten diese Erkenntnisse relevant sein“, sagt Schmidt.
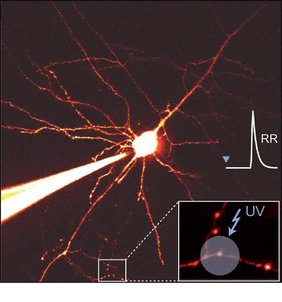
Untersucht wurden die Zellen im primären somatosensorischen Kortex im Gehirngewebe von Mäusen. Für ihre Versuchsreihe kombinierten die Forscher:innen mehrere Methoden: Sie maßen die elektrischen Signale von miteinander verbundenen Pärchen von Nervenzellen per Patch-Clamp-Technik. Zeitgleich kontrollierten und maßen sie die Kalziumkonzentration in den Synapsen – und zwar mittels eines UV-Lasers und eines Zwei-Photonen-Laser-Mikroskops.
Zudem entwickelten sie ein eigenes Verfahren, das sie „axon walking“ nennen. Dieses ermöglicht, entlang der Nervenzellfortsätze, die als Axone bezeichnet werden, die jeweils gerade aktiven vier bis fünf Synapsen aufzuspüren. Diese sind nur etwa eintausendstel Millimeter groß.
Anhand der Daten entwickelten die Wissenschaftler:innen für das untersuchte Sensorprotein ein detailliertes mathematisches Modell, das auch für andere Forschungsgruppen nutzbar ist. Aktuelle Anschlussvorhaben widmen sich der Frage, ob sich die synaptische Signalübertragung innerhalb verschiedener Bereiche der Großhirnrinde noch mehr differenzieren lässt.
Universität Leipzig
Originalpublikation:
Grit Bornschein et al.: The intracellular Ca2+ sensitivity of transmitter release in glutamatergic neocortical boutons. Science 389, 48-52(2025). DOI:10.1126/science.adp0870