Könnten wir uns vier Milliarden Jahre in die Vergangenheit beamen, würden wir uns in einer ziemlich unwirtlichen Umgebung wiederfinden: eine Atmosphäre, in der wir ohne Atemmaske nach ein paar Minuten erstickten, denn Sauerstoff gab es damals nur in geringen Mengen; öde Landflächen ohne Pflanzen oder Tiere; dazu ein ebenso lebloser Ozean. Immerhin enthielt der aber wohl verschiedene gelöste Moleküle. Aus diesen müssen sich immer komplexere Verbindungen gebildet haben, bis Hunderte von Millionen Jahren später schließlich die ersten Mikroorganismen entstanden. So stellen sich zumindest die meisten Wissenschaftler den Ursprung des Lebens vor.
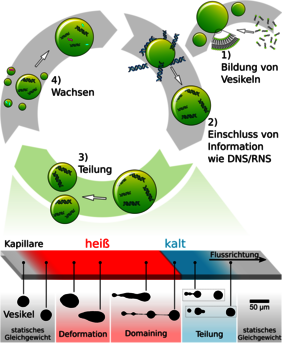
Vor der biologischen gab es also eine chemische Evolution, bei der die einfachen Ausgangssubstanzen der „Ursuppe“ zu komplizierteren Molekülen reagierten. Dazu brauchte es jedoch auch passende „Gefäße“, in denen diese Reaktionen stattfinden konnten. Diese Rolle könnten kleine, von einer fettähnlichen Haut umgebene und mit Flüssigkeit gefüllte Kügelchen übernommen haben – die so genannten Lipid-Vesikel.
„Wir wissen heute, dass sich derartige Vesikel an der Oberfläche heißer vulkanischer Gesteine am Meeresgrund durchaus hätten bilden können“, erklärt Dr. Christoph Westerhausen, Leiter der Arbeitsgruppe Biophysik an der Universität Augsburg. Die Bläschen tendieren dazu, weitere Lipidmoleküle aus ihrer Umgebung in die sie umgebene Haut einzubauen. Sie werden also immer größer und verlieren gleichzeitig an Stabilität. „Sie müssen sich daher irgendwann teilen, ohne zu platzen“, betont Westerhausen. „Auf welche Weise das geschehen kann, war aber bislang nicht geklärt.“
Zusammen mit der Gruppe um Prof. Dr. Dieter Braun von der Ludwig-Maximilians-Universität München haben die Augsburger Forscher nun einen möglichen Mechanismus dafür vorgeschlagen. Eine Schlüsselrolle spielen hierbei wieder vulkanische Gesteine am Meeresgrund. Diese kühlten sich außen beim Kontakt mit dem Urozean ab; in ihrem Inneren aber bleiben sie heiß.
Vulkangestein ist in der Regel von kleinen Kanälen durchzogen, in denen Wasser zirkulieren kann. Dieses durchläuft bei seiner Strömung verschiedene Temperaturzonen. „Und dieser Effekt kann unter bestimmten Bedingungen dazu führen, dass sich im Wasser enthaltene Vesikel teilen“, sagt Westerhausen.
Temperaturunterschiede zerreißen die Protozellen kontrolliert
Ursache dafür ist das Verhalten der Lipidhülle, die je nach Temperatur unterschiedliche Zustände einnimmt: Bei niedrigen Temperaturen ist das hauchdünne Häutchen gelartig. Seine Bausteine, die Lipide, liegen dicht gepackt nebeneinander. Wenn die Temperatur einen bestimmten Wert über-schreitet, ändert die Hülle aber schlagartig ihren Zustand – Experten sprechen auch von einem Phasenübergang: Die Lipide sind nun plötzlich viel beweglicher, benötigen aber auch deutlich mehr Platz. Das Volumen des Vesikels ändert sich derweil aber nicht.
„Ein kühles Vesikel ist in der Regel kugelförmig“, erklärt Christoph Westerhausen. „In dieser Form kann es mit seiner geringen Oberfläche am meisten Inhalt speichern.“ Beim Phasenübergang würde die nun plötzlich viel größere Lipidhaut aber gewissermaßen Falten werfen. Um das zu verhindern, nimmt sie eine neue Gleichgewichtsform an, bei der das Vesikel in eine langgestreckte Hantelform übergeht: Es besteht nun aus mehreren bauchigen Aussackungen vergleichbarer Größe, die jeweils durch einen dünnen Lipid-Kanal verbunden sind.
Wenn der vordere Teil dieser Hantel nun wieder in eine kühlere Umgebung gerät, wird er schlagartig wieder gelartig. Dabei schnurrt die vordere Aussackung zusammen, und ihr Inhalt muss durch den Lipid-Kanal in die zweite Aussackung gedrückt werden, die sich noch im warmen Wasser befindet. Durch die so entstehende Spannung der Lipidhülle kann der Lipid-Kanal abreißen. Die dabei entstehenden Löcher im Vesikel verschließen sich direkt wieder: Das Vesikel hat sich geteilt. „Als experimentellen Nachbau der dünnen Gesteinsporen verwendeten wir im Labor sehr feine Glasröhrchen, deren Temperatur an einer bestimmten Stelle erhöht ist“, sagt Westerhausen. „Durch diese Röhrchen haben wir Vesikel strömen lassen, und mit einem Spezialmikroskop betrachtet. Tatsächlich konnten wir beobachten, dass sich die hantelförmigen Vesikel genau am Punkt der Temperaturänderung teilten.“
Das Charmante an dem Augsburg-Münchner Vorschlag ist, dass er keine unrealistischen Bedingungen voraussetzt: Noch heute finden sich am Grunde der Weltmeere vulkanische Gesteine, die in ihrem Innern einen Temperaturgradienten aufweisen. Vielleicht waren sie einst die treibenden Kräfte hinter der Entstehung des Lebens, denen auch wir unsere Existenz verdanken.
Universität Augsburg
Originalpublikation:
Patrick W. Kudella, Katharina Preißinger, Matthias Morasch, Christina F. Dirscherl, Dieter Braun, Achim Wixforth & Christoph Westerhausen: Fission of Lipid-Vesicles by Membrane phase transi-tions in thermal convection; Scientific Reports; 2020