Obwohl die DNA im Zellkern dicht gepackt und gut geschützt ist, ist sie ständig Gefahren ausgesetzt – etwa durch normale Stoffwechselprozesse oder äußere Einflüsse wie Strahlung oder chemische Substanzen. Um dem entgegenzuwirken, verfügen Zellen über ein komplexes Netz an Reparaturmechanismen. Versagen diese Systeme, können sich DNA-Schäden ansammeln, die das Funktionieren der Zelle beeinträchtigen und zur Entstehung von Krebs, Alterungsprozessen und degenerativen Erkrankungen beitragen.
Eine besonders schwerwiegende Form von DNA-Schäden sind sogenannte DNA-Protein-Quervernetzungen (DNA-Protein Crosslinks, DPCs), bei denen Proteine an die DNA geheftet werden. DPCs können durch Alkoholkonsum, durch die Einwirkung von Substanzen wie Formaldehyd oder anderen Aldehyden oder durch Fehler von Enzymen entstehen, die an der Verdopplung oder Reparatur der DNA beteiligt sind. Weil DPCs die Verdopplung der DNA blockieren, können sie schwere Fehler bei der Zellteilung verursachen. Daher stellen DPCs eine erhebliche Bedrohung für die Integrität des Genoms dar.
Das Enzym SPRTN beseitigt DPCs, indem es die Verbindung zwischen DNA und Proteinen spaltet. Menschen, bei denen SPRTN mutiert ist und nicht mehr korrekt funktioniert, können bereits im Jugendalter Knochenfehlbildungen und Leberkrebs entwickeln. Diese seltene genetische Erkrankung ist als Ruijs-Aalfs-Syndrom bekannt. Die zugrunde liegenden Mechanismen sind bislang nur unzureichend verstanden, spezifische Therapien gibt es nicht.
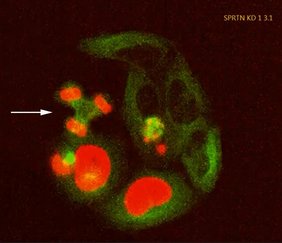
Jetzt konnte ein Forschungsteam unter der Leitung von Prof. Ivan Ðikić vom Institut für Biochemie II der Goethe-Universität Frankfurt zeigen, dass der Verlust eines funktionsfähigen SPRTN-Enzyms nicht nur dazu führt, dass die DNA im Zellkern immer mehr Defekte aufweist. In Zellkulturexperimenten und mithilfe genetisch veränderter Mäuse stellten die Forschenden fest, dass zusätzlich DNA aus dem Zellkern ins Zellinnere, das Zytoplasma, gelangt.
DNA im Zytoplasma ist für die Zelle ein Alarmsignal. Denn solche DNA stammt normalerweise von eindringenden Viren oder Bakterien oder ist ein Zeichen für eine Entartung der Zelle. Zytoplasmatische DNA aktiviert daher Abwehrmechanismen der Zelle, indem sie den sogenannten cGAS-STING-Signalweg auslöst. Zudem setzt die Zelle Botenstoffe frei, die Immunzellen anlocken, die zu einer chronischen Entzündung führen.
Das Forschungsteam beobachtete, dass diese chronische Entzündungsreaktion besonders stark in Maus-Embryonen ausgeprägt ist. Sie hält an, bis die Mäuse ausgewachsen sind und zeigt sich dann vor allem in Lunge und Leber. In der Folge starben die Mäuse früh oder sie zeigten Symptome eines vorzeitigen Alterns, die denen von Menschen mit Ruijs-Aalfs-Syndrom ähneln. Blockierten die Forschenden die betreffende Immunreaktion, ließen sich viele der Symptome lindern.
„DNA-Protein-Quervernetzungen, die nicht repariert werden können, haben weitreichende systemische Konsequenzen“, erklärt Ðikić. „Sie gefährden nicht nur die Stabilität des Genoms, sondern treiben auch chronische Entzündungen an, die die Lebensspanne erheblich beeinflussen können.“
Der Mediziner und Molekularbiologe sieht darin das Potenzial für die Entwicklung neuer Therapien: „Neben dem Ruijs-Aalfs-Syndrom gibt es weitere seltene genetische Erkrankungen, bei denen DNA-Protein-Quervernetzungen eine wichtige Rolle spielen. Mit unserer Arbeit haben wir eine wichtige Grundlage geschaffen, um neue therapeutische Ansätze auch für diese Krankheiten zu entwickeln. Durch die Untersuchung der zugrunde liegenden Mechanismen seltener Erkrankungen haben wir einen neuen Zusammenhang zwischen DNA-Schäden, Entzündungsreaktionen und der Lebensspanne eines Organismus entdeckt. Das trägt auch dazu bei, die Biologie des Alterns besser zu verstehen.“
Zu den Partnern des Forschungsprojekts gehörten die Goethe-Universität und die Johannes Gutenberg-Universität Mainz (Institut für Molekularbiologie/Professorin Petra Beli und Institut für Transfusionsmedizin/Professorin Daniela Krause) innerhalb der Allianz der Rhein-Main-Universitäten (RMU), das Deutsche Konsortium für translationale Krebsforschung (DKTK), das Deutsche Krebsforschungszentrum (DKFZ), die EPFL Lausanne, die Charité Berlin sowie die Universitäten Köln und Split (Kroatien).
Goethe-Universität Frankfurt
Originalpublikation:
Ines Tomaskovic et al.: DNA-protein cross-links promote cGAS-STING–driven premature aging and embryonic lethality. Science391, eadx9445(2026). DOI:10.1126/science.adx9445