Die Zellteilung ist für die korrekte Übertragung genetischer Informationen unerlässlich. Jedes Chromosom enthält ein Zentromer, einen Bereich, der eine zentrale Rolle bei der Steuerung der Chromosomenbewegung während der Zellteilung spielt. Der Kinetochor-Proteinkomplex bildet sich am Zentromer und dient als Anheftungsstelle für Spindelfasern, die die Chromosomen zu den entgegengesetzen Zellpolen ziehen. KINETOCHORE NULL2 (αKNL2) ist ein wichtiges Kinetochor-Protein, das eine zentrale Rolle beim Aufladen des zentromeren Histons H3 (CENH3) auf die Zentromere und beim Aufbau des Kinetochors spielt.
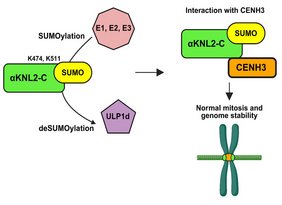
Damit das Kinetochor richtig funktioniert, müssen viele Proteinkomponenten koordiniert zusammenwirken. Unter diesen Regulatoren spielen Proteine der SUMO-Familie (Small Ubiquitin-related Modifiers) eine besonders wichtige Rolle. Kleine SUMO-Proteine können kovalent an Zielproteine, darunter auch Kinetochor-Komponenten, gebunden werden, ein Prozess, der als SUMOylierung bezeichnet wird. Diese Modifikation kann die Stabilität, Lokalisierung, Interaktionen oder Gesamtaktivität eines Proteins verändern und ist für die Feinabstimmung zahlreicher zellulärer Prozesse unerlässlich.
In dieser Studie identifizierte das IPK-Team mehrere αKNL2-interagierende Proteine, die zum SUMOylierungsweg gehören, was darauf hindeutet, dass αKNL2 durch SUMO reguliert wird. „Wir haben festgestellt, dass αKNL2 durch SUMO-Proteine modifiziert wird, und dann gezeigt, wie diese SUMOylierung seine Funktion beeinflusst“, erklärte Manikandan Kalidass, Erstautor der Studie. Mithilfe biochemischer Experimente und computergestützter Analysen kartierten die Forscher außerdem spezifische SUMO-Bindungsstellen im C-terminalen Bereich (am Ende der Proteinkette) von αKNL2.
In einem nächsten Schritt untersuchte das IPK-Forschungsteam, was passiert, wenn diese SUMO-Bindungsstellen verändert werden und αKNL2 nicht mehr richtig SUMOyliert werden kann. „Die SUMO-Stellen auf αKNL2 sind für dessen normale Aktivität entscheidend. Wenn die SUMOylierung gestört ist, entwickelt die Modellpflanze Wachstums- und Fruchtbarkeitsstörungen,“ sagt Dr. Inna Lermontova, Leiterin der IPK-Forschungsgruppe „Kinetochore Biology“.
Auf zellulärer Ebene schwächt eine verminderte SUMOylierung die Wechselwirkung zwischen αKNL2 und CENH3 und destabilisiert den Kinetochor. Das führt zu Fehlern bei der Trennung der Chromosomen und verursacht so letztlich die Entwicklungsstörungen.
Die Studie zeigt, wie wichtig dieser Regulationsmechanismus für die αKNL2-Aktivität in Arabidopsis thaliana ist. „Unsere Ergebnisse liefern ein besseres Verständnis dafür, wie die SUMOylierung die Proteinfunktion während der Chromosomensegregation reguliert. Und dies könnte Auswirkungen auf ähnliche Mechanismen in anderen eukaryotischen Systemen haben“, sagte Dr. Inna Lermontova.
Leibniz-Institut für Pflanzengenetik und Kulturpflanzenforschung
Originalpublikation:
Kalidass, M., et al. (2025): The C-terminal SUMOylation-dependent regulation of αKNL2 governs its centromere targeting and interaction with CENH3. Plant Communications. DOI: 10.1016/j.xplc.2025.101617