Das Gen p53 wirkt in gesunden Körperzellen als Tumorsuppressor, verhindert also Krebs. In Tumorzellen ist p53 meist mutiert, so dass es unwirksam ist. „Mutationen im p53-Gen sind die häufigsten Genmutationen in Krebszellen“, erklärt Thorsten Stiewe, der die Forschungsarbeit leitete.
Mitunter kehrt sich die Aktivität von p53 durch eine Mutation sogar um: Dann hemmt das Genprodukt nicht die Bildung von Krebs, sondern es fördert Tumore sogar. Insbesondere erhöht es deren Fähigkeit, Metastasen zu bilden. „In einer früheren Studie haben wir bereits gezeigt, über welche nachgeschalteten Moleküle mutiertes p53 wirkt, wenn es die Ausbreitung des Tumors vorantreibt“, berichtet Stiewe.
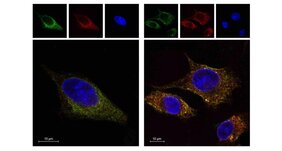
An diese Ergebnisse knüpfte das Team nun an und klärte den zugrunde-liegenden Mechanismus weiter auf. Die Forschungsgruppe interessierte sich besonders für Integrinproteine. „Integrine sind entscheidend dafür, dass Tumorzellen in umliegendes Gewebe einwandern, wobei sie sich an Fasern entlanghangeln“, erläutert Stiewes Mitarbeiter Dr. Evangelos Pavlakis, einer der Leitautoren des Fachaufsatzes.
Die beteiligten Wissenschaftlerinnen und Wissenschaftler aus den Instituten für molekulare Onkologie und für Tumorimmunologie der Philipps-Universität analysierten Krebszellen mit p53-Mutationen, um herauszufinden, wie sie die Proteine Integrin-a5 und Integrin-b1 beeinflussen. Das mutierte p53-Gen bewirkt demnach über mehrere Zwischenschritte, dass sich die Tumorzellen an Fasern anheften, was die Beweglichkeit der Tumorzellen steigert. Im Tierversuch an Mäusen zeigt die Forschungsgruppe, dass sich durch den beschriebenen Prozess vermehrt Metastasen in der Leber bilden.
„Besonders aufschlussreich ist der Befund, dass sich die Überlebenschance bei Bauchspeicheldrüsenkrebs verschlechtert, wenn bei den Patientinnen und Patienten Integrine in großen Mengen vorliegen“, hebt Stiewe hervor.
Das Team untersuchte auch die Möglichkeit, den beschriebenen Mechanismus zu blockieren. „In Zellkultur bewirken verschiedene Maßnahmen, dass Krebszellen weniger Metastasen bilden“, sagt der Krebsforscher. Greift man die p53-Mutanten und deren Bindungspartner mittels spezieller Wirkstoffe wie Ganetespib und anderer Hsp90-Inhibitoren an, so sinkt die Beweglichkeit der betroffenen Krebszellen.
„Hsp90-Inhibitoren wurden auch im Tiermodell getestet“, erzählt Stiewe; „sie hemmen sowohl das Wachstum von Bauchspeicheldrüsenkrebs als auch dessen Metastasenbildung.“ Ob sich daraus tatsächlich ein therapeutischer Nutzen ziehen lässt, müsse aber erst noch in weiteren Studien untersucht werden.
Professor Dr. Thorsten Stiewe lehrt molekulare Onkologie an der Philipps-Universität. Die Deutsche Krebshilfe, die Deutsche Forschungsgemeinschaft, das Deutsche Zentrum für Lungenforschung, die Deutsche Jose Carreras Leukämie-Stiftung, das Hessische Wissenschaftsministerium, das Bundesforschungsministerium sowie die Von Behring-Röntgen-Stiftung unterstützten die zugrunde liegende wissenschaftliche Arbeit finanziell.
Universität Marburg
Originalpublikation:
Evangelos Pavlakis & al.: „Mutant p53-ENTPD5 control of the calnexin/calreticulin cycle: a druggable target for inhibiting integrin-α5-driven metastasis“, Journal of Experimental and Clinical Cancer Research 2023, DOI: https://doi.org/10.1186/s13046-023-02785-z