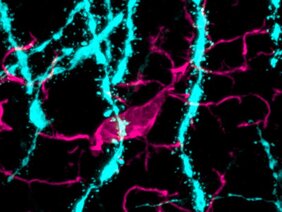
Die Forschenden des Instituts für Neuropathologie des Universitätsklinikums Freiburg konnten die verursachenden Mechanismen der neuropsychologischen Störungen entschlüsseln. So ließen sich bei männlichen Mäusen vermehrt T-Zellen im Gehirn nachweisen. Zudem konnte beobachtet werden, wie Makrophagen, auch als Fresszellen bezeichnet, im Gehirn verstärkt dendritische Dornfortsätze von Nervenzellen abbauen. Diese Fortsätze spielen beim Lernen eine wichtige Rolle. Die molekularen Veränderungen und neuropsychologischen Auffälligkeiten ließen sich nicht nur bei einer echten Virusinfektion nachweisen. Auch bei einer medikamentösen Nachahmung einer Virusinfektion traten die langanhaltenden Konzentrations- und Verhaltensstörungen nur bei männlichen Mäusen auf.
Botenstoff als treibende Kraft
Der akute Krankheitsverlauf nach Virusexposition schien bei beiden Geschlechtern zunächst ähnlich, nicht aber für den Botenstoff Interferon Gamma, der eine immunstimulierende Wirkung hat. „Während sich die Spiegel zahlreicher Botenstoffe in der Milz und im Gehirn weiblicher und männlicher Mäuse nicht unterschieden, ließen sich nach der frühen Immunstimulation bei männlichen Mäusen höhere Werte für Interferon-Gamma nachweisen“, erklärt Dr. Marius Schwabenland, Erstautor der Studie und Fellow im IMM-PACT-Clinician Scientist-Programm der Medizinischen Fakultät der Universität Freiburg.
In weiteren Experimenten konnten die Forscher*innen nachweisen, dass es sich bei Interferon-Gamma um die treibende Kraft der vorgefundenen Veränderungen handelt. Durch spezifische Antikörper, welche den Botenstoff Interferon-Gamma neutralisieren, ließen sich die zellulären und molekularen Veränderungen sowie letztendlich die langanhaltenden Konzentrations- und Sozialverhaltensauffälligkeiten vollständig verhindern.
„Der biologische Sinn hinter diesen geschlechtsspezifischen Unterschieden ist uns bisher nicht bekannt“, erläutert Privatdozent Dr. Thomas Blank, Arbeitsgruppenleiter am Institut für Neuropathologie und Letztautor der Studie. „Dennoch sind unsere Erkenntnisse und die Tatsache, dass sich das männliche und weibliche Immunsystem offenbar unterscheiden, sicherlich zukünftig in der Klinik von Bedeutung. Diese Erkenntnisse könnten unter anderem bedeutend werden, wenn es um das Ansprechen von Immuntherapien bei Männern und Frauen geht“, erläutert Blank.
Weitere Studien angedacht
„Langanhaltende Konzentrationsstörungen nach einer ausgeheilten Virusinfektion lassen sich auch beim so genannten Long-COVID-Syndrom infolge einer Infektion mit SARS-CoV-2 beobachten. Inwieweit die festgestellten Mechanismen im Mausmodell die Veränderungen bei Long-COVID erklären könnten, muss in weiteren Studien untersucht werden“, erklärt Prof. Dr. Marco Prinz, Ärztlicher Direktor des Instituts für Neuropathologie.
Prof. Dr. Robert Thimme, Ärztlicher Direktor der Klinik für Innere Medizin II des Universitätsklinikums Freiburg und Sprecher des IMM-PACT-Clinician Scientist-Programms, lobt die enge Verzahnung zwischen Grundlagenforschung und Patient*innenversorgung. „Unser Qualifizierungsprogramm bietet jungen Mediziner*innen optimale Voraussetzungen für die Kombination einer wissenschaftlichen und klinischen Laufbahn. Die in den Forschungsprojekten gewonnenen Erkenntnisse werden zu verbesserten Behandlungsstrategien immunvermittelter Erkrankungen beitragen.“
Universitätsklinikum Freiburg
Originalpublikation:
Schwabenland, M., Mossad, O., Sievert, A. et al. Neonatal immune challenge poses a sex-specific risk for epigenetic microglial reprogramming and behavioral impairment. Nat Commun14, 2721 (2023). doi.org/10.1038/s41467-023-38373-0