„Wir haben bei Krebszellen mit abnormaler Chromosomenzahl eine verwundbare Stelle gefunden“, bestätigt Dr. Zuzana Storchová, Professorin für Molekulargenetik an der Technischen Universität Kaiserslautern (TUK) in Deutschland und Co-Autorin der Studie.
Normale, gesunde Zellen haben 46 Chromosomen, aber bösartige Tumore bestehen oft aus hochgradig abnormen Krebszellen, die eine abweichende Anzahl enthalten, zumeist zwischen 60 und 90 Chromosomen. Sie werden als aneuploide Krebszellen bezeichnet. Lange Zeit dachten Forscher, Aneuploidie sei ein Nebeneffekt von Zellen, die krebsartig werden, aber in den letzten 15 Jahren verdichten sich die Anzeichen, dass dies eine der treibenden Kräfte von Krebs sein könnte. Die Suche nach einem gemeinsamen Merkmal, das mit dieser abweichenden Chromosomenzahl verbunden ist, könnte entscheidend sein, um Krebs zu bekämpfen, unabhängig davon, wo er sich im Körper entwickelt.
Krebs hat eine Achillesferse
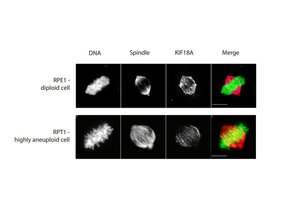
Storchová und ihre Mitarbeiter führten umfangreiche Experimente mit fast 1.000 Zelllinien von menschlichen Krebspatienten und im Labor gezüchteten Modellkrebszellen durch. Schließlich identifizierten sie ein Protein namens KIF18A, das für aneuploide Krebszellen essentiell ist, um einen wichtigen Prozess der Zellteilung (Mitose), die sogenannte Chromosomensegregation, zu durchlaufen. Wenn bei der Segregation von Chromosomen zu viele Fehler gemacht werden, wird ein Checkpoint am sogenannten Spindelapparat (der die Aufteilung Schwesterchromosomen koordiniert) aktiviert. Daraufhin wird die Zellteilung verzögert, bis die Fehler korrigiert sind. Aneuploide Krebszellen machen dennoch in der Regel weiter, trotz der zusätzlichen Chromosomen, und begehen mehr Fehler während der Mitose. Die Forscher fanden heraus, dass diese, wenn der Checkpoint nicht richtig funktioniert und nicht in der Lage ist, die Teilung zu stoppen, anscheinend so viele Fehler begehen, dass sie nicht überleben können. Zusätzlich fanden sie heraus, dass, wenn das KIF18A-Protein blockiert ist, diese Zellen mit größerer Wahrscheinlichkeit sterben als Zellen mit einer normalen Anzahl von Chromosomen.
„Wir waren in der Lage, modernste Werkzeuge auf eine uralte Frage in der Krebsbiologie anzuwenden: Was ist die Achillesferse von Chromosomenzahl-Veränderungen bei Krebs?“, sagt Dr. Uri Ben-David, Assistenzprofessor an der Tel Aviv University in Israel und Co-Autor der Studie. „Ich bin begeistert, dass unsere Ergebnisse, wenn sie sich im klinischen Umfeld bestätigen, verschiedene therapeutische Wege zur Versorgung von Krebspatienten eröffnen könnten.“
KIF18A ist ein Kinesin-Motorprotein, das an die mitotische Spindel bindet und diese reguliert; eine molekulare Struktur, die eine korrekte Chromosomenteilung ermöglicht. Die Forscher wissen noch nicht genau, was KIF18A in aneuploiden Zellen anders macht als in normalen Zellen, aber sie vermuten, dass es der sich teilenden Zelle irgendwie hilft, die abnorm hohe Anzahl von Chromosomen physikalisch unterzubringen. Durch Bildgebung von lebenden Zellen sehen sie, dass die mitotische Spindel in den aneuploiden Zellen eine andere Form hat als in normalen Zellen. Dies wird ein Ansatzpunkt für weitere Forschungen sein.
„Im Moment gibt es keine Inhibitoren, die KIF18A in menschlichen Zellen blockieren. Wenn wir jedoch den Mechanismus besser verstehen, könnten wir gegebenenfalls chemische Moleküle entwickeln, die KIF18A selbst oder die damit verbundenen Prozesse angreifen“, sagt Storchová.
Aus Zufall wird erfolgreiche Zusammenarbeit
Storchová untersucht, wie überzählige Chromosomen die Zellphysiologie, Funktion und Entwicklung von Krebszellen beeinflussen. Vor einigen Jahren beobachteten sie und ihr Team, dass KIF18A für Modellversionen von aneuploiden Krebszellen essentiell zu sein schien, aber zu der Zeit gab es keine öffentlich zugänglichen Daten, um den Befund auf menschliche Krebsarten zu übertragen. Sie legte den Befund beiseite, bis sie 2017 Ben-David auf einer Konferenz traf. Während eines informellen Gesprächs erklärte er, dass er fast 1.000 Krebszelllinien von Patienten untersuchte, um nach einer gemeinsamen Schwachstelle zu suchen. Sie erwähnte ihre Arbeit an KIF18A, und als er seine Daten überprüfte, stellte er fest, dass das Protein auch für diese Zellen von großer Bedeutung war. Weitere Analysen, die in den letzten Jahren durchgeführt wurden, halfen ihnen, andere Proteine und Gene auszuschließen und zu beweisen, dass KIF18A die wesentliche Komponente ist.
„Das erinnert uns daran, wie wichtig der informelle Austausch zwischen Wissenschaftlern ist“, sagt Storchová. „Und es zeigt, wie komplex die Wissenschaft sein kann, und dass wir manchmal einen langen Weg gehen müssen. Es hat einige Zeit gedauert, bis wir ausreichend Beweise vorliegen hatten, um zu veranschaulichen, dass dies nicht nur eine zufällige Beobachtung ist, die in unseren Modellen gültig ist, sondern ein allgemeineres Prinzip darstellt.“
Ben-David stimmte zu und unterstreicht die Bedeutung der Grundlagenforschung, die lange dauern kann, bevor sie zu medizinischen Durchbrüchen führt. „Klinische Entdeckungen entstehen immer aus grundlegenden wissenschaftlichen Erkenntnissen“, sagt er. „Unsere Ergebnisse basieren alle auf Zellkulturen und deshalb wissen wir noch nicht, wie gut sie sich auf tatsächliche menschliche Patienten übertragen lassen. Dennoch eröffnen sie vielversprechende Forschungsgebiete, die das Potenzial haben, letztlich die Versorgung von Krebspatienten zu beeinflussen.“
Forschung in COVID-Zeiten
Die Coronavirus-Pandemie stellte eine große Herausforderung für das Projekt dar, da viele der Laboreinrichtungen vorübergehend geschlossen werden mussten. Die Erstautorin der Arbeit, Yael Cohen-Sharir, beendete die Schlüsselexperimente an der Universität Tel Aviv zwei Tage bevor Israel in einen einmonatigen Lockdown ging. Das Forschungsteam, zu dem auch die Universität Mailand und das Europäische Institut für Onkologie in Italien sowie das Broad Institute des Massachusetts Institute of Technology und der Harvard University, das Dana Farber Cancer Institute, und die University of Vermont in den USA gehörten, half sich gegenseitig -
wer Zugang zu einem Labor hatte, führte die notwendigen Tests durch. "Zu jedem Zeitpunkt hatten wir mindestens ein Labor irgendwo auf der Welt, das offen und bereit war, uns zu helfen", sagte Ben-David.
Storchová lobte insbesondere die TUK-Doktorandin Sara Bernhard und die Studierende Lisa-Marie Stautmeister für ihre „absolut großartige Arbeit“, zusätzliche Messungen durchzuführen, die für die Fertigstellung der Arbeit während der Pandemie erforderlich waren.
TU Kaiserslautern
Original-Publikation:
Yael Cohen-Sharir et al., “Aneuploidy renders cancer cells vulnerable to mitotic checkpoint inhibition”, Nature, DOI: 10.1038/s41586-020-03114-6.