Georg Winters Labor am CeMM erforscht molekulare Grundlagen der Genkontrolle und deren Veränderungen bei Krebserkrankungen. Um zu verstehen wie sogenannte Genschalter und ihre biochemischen Abläufe funktionieren, kombiniert das Team gezielten Proteinabbau mit Messungen der Genaktivität bei hoher zeitlicher Auflösung. Die „dTAG“ genannte Methode zum gezielten chemischen Abbau markierter Proteine wurde von Georg Winter im Labor von Jay Bradner am Dana Farber Cancer Institut in Boston mitentwickelt. In Zusammenarbeit mit Patrick Cramers Labor und weiteren internationalen Partnern konnten die WissenschaftlerInnen am CeMM durch solch gezielten Proteinabbau erstmals zeigen, welche regulatorische Aufgabe dem Genschalter Mediator im Menschen zukommt. Aufgrund der Komplexität des Mediators und der damit verbundenen experimentellen Herausforderungen, wusste man bisher wenig über seine genaue Funktionsweise im Menschen.
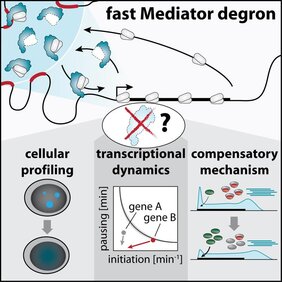
Vor rund 30 Jahren hat die Wissenschaft erstmals erkannt, dass der Mediatorkomplex als Brücke zwischen DNA-gebundenen Proteinen, den sogenannten Transkriptionsfaktoren, und der zellulären Genkopiermaschine RNA Polymerase II (Pol II) fungiert. Um die genaue Rolle von Mediator und die konkreten Abläufe in diesem Prozess zu erforschen, benötigt die Wissenschaft Methoden, die es ermöglichen, den Regulator rasch zu blockieren und danach die Auswirkungen der Blockade auf die Pol II Aktivität innerhalb weniger Minuten zu messen. Mithilfe des gezielten Proteinabbaus ist es dem Team von Georg Winter nun gelungen, einzelne Komponenten des Mediatorkomplexes rasch und gezielt auszuschalten und in der Folge zu beobachten, inwieweit die Kopiervorgänge aller Gene dadurch beeinträchtigt werden. Im Gegensatz zur bestehenden Annahme, dass Mediator für die Transkription aller Gene erforderlich ist, legt die von CeMM PhD Student Martin Jäger verfasste Studie nahe, dass der Genschalter besonders die Expression eines kleinen Satzes von Genen vorantreibt, die eng miteinander verbundene Regelkreise bilden, um zelltypspezifische Funktionen zu steuern.
Durch Einfärben und Sichtbarmachen von Pol II Enzymen in Zellen konnte das Team zeigen, dass der Mediatorkomplex die Transkriptionsmaschinerie in große Cluster organisiert, die sich laut jüngster Forschungsergebnisse um regulatorische DNA-Sequenzen, sogenannte Super-Enhancer bilden. Diese Super-Enhancer stimulieren die Expression zelltypspezifischer Gene, indem sie ihre oft Millionen von DNA-Basen entfernten Zielgene physisch berühren. Die großen Pol II Cluster verschwanden sehr rasch nach dem gezielten Abbau von Mediator, allerdings scheinen die Super-Enhancer ihre Zielgene immer noch zu berühren. Dies weist darauf hin, dass diese DNA-Kontakte auch ohne Mediator aufrechterhalten werden können. Allerdings konnte das Team am CeMM gemeinsam mit Experten aus Cramers Labor beobachten, dass sich die Dynamik des Transkriptionsprozesses bei Genen mit Super-Enhancer-Antrieb nach dem Verlust von Mediator dramatisch verändert. Die Daten legen nahe, dass Mediator-Cluster Pol II-Enzyme gezielt in die Nähe dieser zelltypspezifischen Gene locken, um damit das Kopieren dieser Gene mit großer Effizienz voranzutreiben. Gleichzeitig schien die Mehrheit der übrigen Gene von einem akuten Mediatorverlust überraschend wenig betroffen zu sein, was die Wissenschaftler vermuten ließ, dass diese einen unerwarteten kompensatorischen Schub erfahren hatten.
Im nächsten Schritt konzentrierte sich das Forschungsteam deshalb auf diesen Kompensationsmechanismus und konnte zeigen, dass das sogenannte Promotor-nahe Pausieren von Pol II nach Mediatorverlust verkürzt war. Dieses Pausieren bewirkt normalerweise, dass Pol II Enzyme unmittelbar nach dem Beginn des Kopierens eines Gens einige Minuten lang zurückgehalten werden. Das wartende Pol II Enzym blockiert dabei wie in einem Verkehrsstau das Durchkommen weiterer Pol II Enzyme und begrenzt somit die Anzahl der in einer bestimmten Zeitspanne abgeschriebenen RNA-Kopien. Nach dem Abbau des Mediators beobachteten die WissenschaftlerInnen eine deutliche Verkürzung der Pause, und dass der wichtigste Regulator der Pausendauer, die sogenannte Cyclin-abhängige Kinase 9 (CDK9), effizienter an DNA in Zellen gebunden war und seine Proteinziele aktiver mit einer Phosphatgruppe markiert hat. Durch eine chemische Blockierung der CDK9 Aktivität wurden die Transkriptionsdefekte des Mediatorverlustes weniger selektiv für Super-Enhancer Zielgene, was darauf hinweist, dass die von den WissenschaftlerInnen enthüllte CDK9-Aktivierung die Reaktion der Zellen auf einen akuten Mediator-Verlust beeinflusst. Diese unerwartete Entdeckung legt nahe, dass sich das Pausieren möglicherweise als zelluläre Pufferkapazität entwickelt hat, um schnell auf akute Probleme bei der Rekrutierung von Pol II reagieren zu können und diese teilweise zu kompensieren.
Die CeMM Studie eröffnet neue Möglichkeiten, wie wir in Zukunft die Zusammensetzung von Mediator-gesteuerten Pol II Clustern sowie die kompensatorische Aktivierung von CDK9 als Reaktion auf Transkriptionsstress besser verstehen können. Darüber hinaus könnten die Ergebnisse neue Ansätze für die Bekämpfung von Krankheiten liefern, bei denen die Mediatorfunktion beeinträchtigt ist. Studienleiter Georg Winter: „Wenn man weit in die Zukunft blickt, hat unsere Arbeit möglicherweise auch ein gewisses Potenzial für Mediator als Angriffsziel für therapeutische Wirkstoffe aufgezeigt. Nächste Schritte könnten darin bestehen, nun zielgerichtete Protein-abbauende Moleküle gegen diesen Komplex zu entwickeln.”
CeMM
Originalpublikation:
Martin G. Jaeger et al.: „Selective Mediator dependence of cell-type-specifying transcription”, Nature Genetics 2020, DOI: 10.1038/s41588-020-0635-0